최초 공방 MET 저해제 타브렉타ㆍ탭메코 동시 승인
심부전 치료제 베르쿠보ㆍPCNSL 치료제 베렉스브루도 ‘최초’ 타이틀
지난 11월 다양한 신약들이 국내 허가를 획득한 가운데 독특한 이력을 가진 치료제들도 있어 눈길을 끌고 있다.
첫 테이프는 베렉스브루(성분명 티라브루티닙, 한국오노약품공업)가 끊었다. 지난달 5일 허가를 획득한 베렉스브루는 국내에서 세 번째로 허가를 획득한 브루톤형 티로신인산화효소 저해제(Bruton`s Tyrosine Kinase, BTK)다.
세 번째 BTK 저해제이지만, 아직까지 표준요법이 확립되지 않은 재발성 또는 불응성의 B세포성 원발성 중추신경계 림프종에 대한 적응증은 최초라는 것이 사측의 설명이다.
사측에 따르면, 베렉스부르의 허가는 일본에서 재발성 또는 불응성의 원발성 중추신경계 림프종(PCNSL) 환자를 대상으로 안정성 및 유효성을 평가한 다기관, 비맹검, 비대조 임상 1/2상 연구(ONO-4059-02) 결과가 기반이 됐다.
이 연구의 1차 유효성 평가지표인 객관적 반응률(Objective Response Rate, ORR)은 승인된 용법 및 용량인 480mg(공복시) 투여군에서 52.9%(9/17명)로 나타났다.
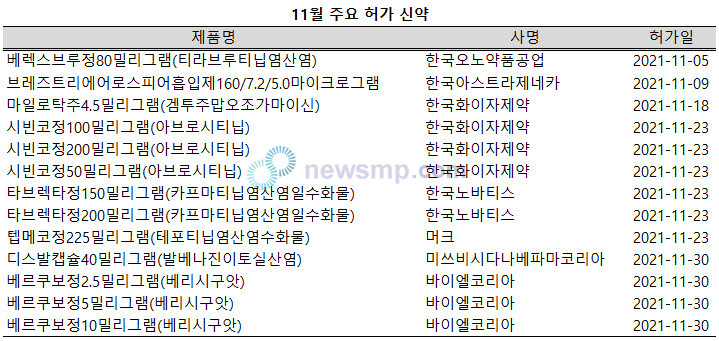
9일에는 ICS/LABA/LAMA 3제 복합 흡입형 COPD 치료제 브레즈트리에어로스피어(성분명 부데소니드/글리코피로니움/포모테롤, 한국아스트라제네카)가 허가를 획득했다.
브레즈트리는 ETHOS 3상 임상에서 LABA/LAMA 복합제인 베베스피 에에로스피어(성분명 포모테롤/글리코피로니움) 및 ICS/LABA 복합제 PT009(성부명 포모테롤/부데소니드)와 비교해 52주차 중등도에서 중증 악화율을 유의하게 줄인 것으로 나타났다.
2제 복합요법으로 적절하게 조절되지 않아 3제 요법이 필요한 환자들이 하나의 흡입기로 투약할 수 있어 순응도 개선에도 기여할 수 있을 전망이다.
경쟁제품인 트렐리지엘립타(성분명 플루티카손/유메클리디늄/빌란테롤, GSK)가 지난 6월 건강보험에 진입한 가운데 3제 복합제들도 본격적인 경쟁구도에 돌입하게 됐다.
특히 한 발 앞서 출시된 트렐리지가 1일 1회 투약이라는 편의성을 강조하며 선공을 펼치고 있어, 1회 투약에 두 번, 1일 최대 두 차례 투약해야 하는 브레즈트리가 내놓을 타개책에 관심이 쏠린다.
18일에는 사연 많은 마일로탁(성분명 겜투주맙, 한국화이자제약)이 새로 진단된 CD33 양성 성인 급성 골수성 백혈병 환자의 1차 치료제로 허가를 획득했다.
사측에 따르면, 국내에서 마일로탁은 지난 2019년 12월 희귀의약품으로 지정받았으며, 18일 정식 허가를 획득, 최초이자 현재까지 유일한 CD33 양성 급성 골수성 백혈병 치료제가 됐다. 이에 앞서서는 2012년, 임의비급여 논란의 중심에 섰던 약물이기도 하다.
해외에서는 2000년 FDA의 승인을 받은 이후 추적 연구에서 생존 기간에 실익이 없는 것으로 나타나 2010년 자진 취하했던 품목이다.
그러나 용법ㆍ용량을 변경해 진행한 새로운 연구에서 긍정적인 결과를 도출, 자진 철수 후 7년만인 지난 2017년 FDA의 재승인을 받아냈다.
만 50-70세의 이전 치료 경험이 없는 새로이 진단된 급성 골수성 백혈병 환자 271명을 대상으로 진행된 오픈라벨, 무작위 배정, 다기관 3상 ALFA-0701 임상시험에서 기존 항암화학요법에 마일로탁을 추가한 환자들의 무사건 생존율(Event-Free Survival, EFS) 및 무재발 생존율(Relapse-Free Survival, RFS)을 크게 개선했다는 것.
전체생존기간(Overall Survival, OS) 역시 절대값으로는 마일로탁 추가 병용요법이 6개월 가까이 더 길었지만, 통계적 유의성은 없었다.
23일에는 야누스 키나아제(Janus kinase, JAK) 억제제 계열 아토피피부염 치료제 시빈코(성분명 아브로시티닙, 화이자)과 MET 저해제 타브렉타(성분명 카프마티닙, 노바티스), 탭메코(성분명 테포티닙, 머크)이 동시에 허가를 받았다.
이 가운데 나란히 비소세포폐암에 적응증을 획득한 타브렉타와 탬메코는 ‘최초’의 타이틀을 두고 은근히 신경전을 펼치고 있다.
탭메코는 지난해(2020년 3월) 일본에서 허가를 획득한 이후 올해 2월 미국 FDA의 승인을 받았으며, 타브렉타는 지난해 5월 FDA의 허가를 받았다.
이에 주요 외신에서는 그간 ‘세계 최초’, ‘FDA 최초’라는 타이틀로 두 약제를 소개해 왔으며, 국내에서는 23일, 동시에 등재됐다. 품목기준코드로는 탭메코가 약간 앞선다.
JAK 억제제로는 올루미언트(성분면 바리시티닙, 릴리)와 린버크(성분명 유파다시티닙, 애브비)에 이어 아토피 피부염에 승인을 획득한 시빈코는 지난 9월 세계 최초로 영국에서 허가를 획득한 지 두 달 만에 국내에서 승인을 획득, 눈길을 끌고 있다.
항체치료제인 듀피젠트(성분명 듀필루맙, 사노피)과 비교해 상대적으로 빠른 가려움증 개선 효과를 내세우고 있는 JAK 억제제 중 하나로, 50mg, 100mg, 200mg 등 세 가지 용량으로 허가를 받아 선택의 폭을 넓혔다는 점을 강조하고 있다.
11월의 신약 허가 랠리는 마지막 날까지 이어졌다. 30일, 지연 운동이상증 개선제 디스발(성분명 발베나진, 미쓰비시다나베파마코리아)와 만성 심부전 치료제 베르쿠보(성분명 베리시구앗, 바이엘)이 허가를 획득한 것.
이 가운데 베르쿠보는 ‘심부전으로 입원했거나 외래에서 정맥용 이뇨제 투여를 경험한 환자 중, 좌심실 박출률 45% 미만의 증상성 만성 심부전 환자’에 적응증을 획득했다.
최근 안지오텐신수용체 네프릴리신억제제(ARNI) 엔트레스토(성분명 사쿠비트릴/발사르탄, 노바티스)에 이어 SGLT-2 억제제 포시가(성분명 다파글리플로진, 아스트라제네카), 자디앙(성분명 엠파글리플로진, 베링거인겔하임) 등이 연이어 심부전에서 희소식을 전하고 있는 가운데, 베르쿠보는 ‘세계 최초(First-in-class)의 수용성 구아닐산 고리화효소(soluble Guanylate Cyclase) 자극제 계열 만성 심부전 치료제’를 내세우고 있다.
사측에 따르면 베르쿠보는 심장 수축, 혈관 긴장도, 심장 재형성 등을 조절하는 세포내 고리형 일인산 구아노신(cGMP)의 합성을 촉진해 심근 및 혈관 기능을 개선한다.
베르쿠보와 같은 날 허가를 획득한 디스발은 현재까지 치료 방법이 제한적인 지연 운동이상증 치료에 새로운 기회를 제공할 것으로 기대된다.
사측은 디스발이 시냅스 이전의 소포체 모노아민 수송체 VMAT2(vesicular monoamine transporter 2)를 선택적으로 저해, 신경 말단에서의 도파민 분비를 가역적으로 감소시키고, 그 결과 지연 운동이상과 관련된 불수의적 운동을 감소시킨다고 소개했다.


