[의약뉴스] 다케다의 3세대 표적치료제 아이클루시그(성분명 포나티닙)가 이매티닙(오리지널 제품명 글리벡, 노바티스)를 압도했다.
15일(현지시간) 미국 임상종양학회 월간 플래너리(ASCO Monthly Plenary series)에서는 신규 진단된 필라델피아염색체 양성 급성 림프구성 백혈병(Ph+ ALL) 환자를 대상으로 아이클루시그와 글리벡을 비교하고 있는 글로벌 3상, PhALLCON 임상 연구의 첫 번째 분석 결과가 발표됐다.
아이클루시그는 BCR::ABL1 및 가장 저항성이 높은 T315I 변이를 포함한 모든 알려진 단일 치료 저항성 변이를 표적으로 하는 유일한 범-돌연변이 3세대 티로신 키나아제 억제제(Tyrosine Kinase Inhibitor, TKI)로 국내에서는 한국오츠카제약이 허가를 받았다.
PhALLCON은 새로 진단된 Ph+ ALL 성인 환자를 위한 1차 치료요법으로 저강도 항암화학요법에 아이클루시그 또는 이매티닙 병용요법의 안전성과 유효성을 비교하고 있는 무작위 대조, 레이블 공개, 다국가 임상으로, Ph+ ALL에서 최초로 진행된 표적치료제간 직접 비교 임상이다.
앞서 다케다는 지난해 11월, 이 연구이 1차 분석에서 1차 목표를 달성했다는 톱라인(Top-line) 리포트를 발표한 바 있으며, 15일에는 보다 구체적인 결과를 공개했다.
이 연구에는 총 245명의 참여, 환자가 각각 2대 1로 아시클루시그 그룹(164명)과 이매티닙 그룹(81명)에 배정됐다.
환자들은 유도요법 기간 3주기, 공고요법 기간 3주기, 공고요법 후 14주기 등 총 20주기에 걸쳐 저강도 항암화학요법과 함께 시험약을 투약했으며, 20주기 이후로는 질병이 진행되거나 독성을 견디기 힘들 때까지 시험약 단독요법으로 치료를 이어갔다.
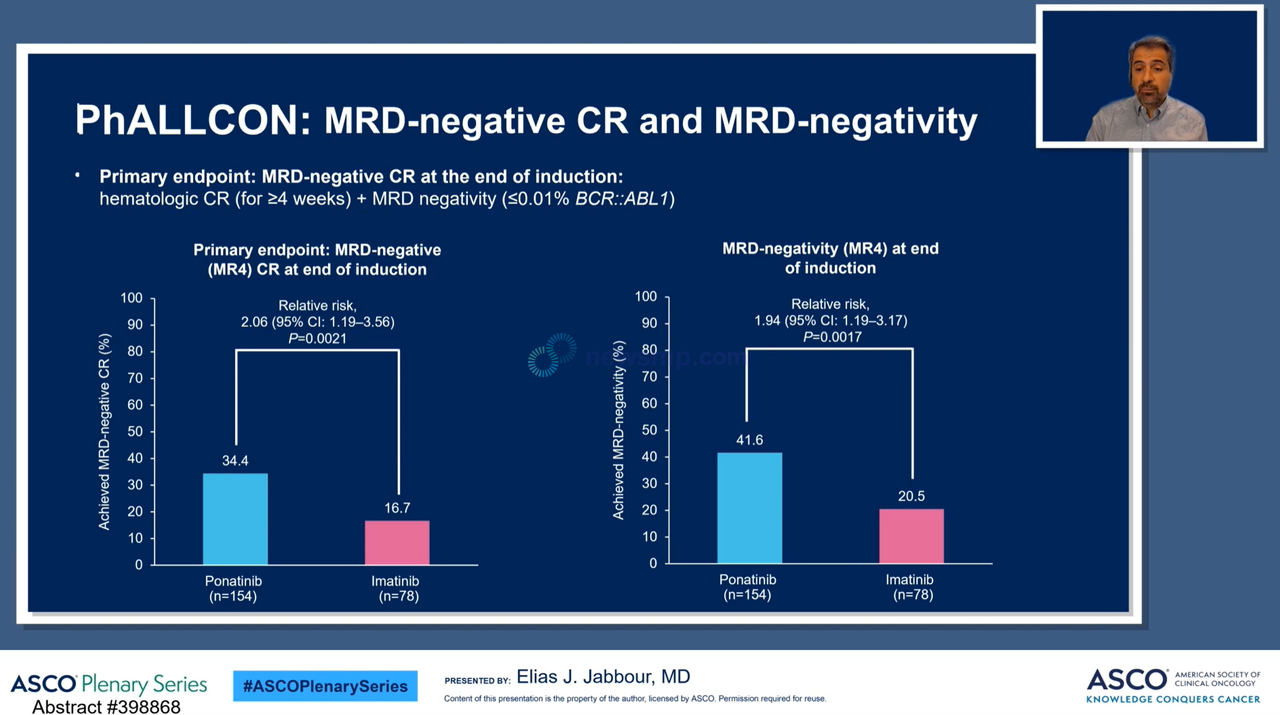
연구의 1차 복합 평가변수는 유도 요법 기간이 마무리된 4주차 미세잔존질환(Minimal Residual Disease) 음성(BCR::ABL1 0.01% 이하) 완전관해(Complete Response, CR)로 정의했다.
주요 2차 평가변수로는 모든 원인으로 인한 사망, 유도요법 마무리 시점에서 완전관해 실패, 완전관해 후 재발 등의 사건이 없는 생존(Event-Free Survival, EFS)로 설정했다.
15일에 공개된 1차 분석은 중앙추적관찰 18~20개월(아이클루시그 투약군 20개월, 이매티닙 투약군 18개월) 시점의 데이터로, 아이클루시그 투약군의 42%가 배정된 치료를 유지하고 있었던 반면, 이매티닙 투약군은 12%만 배정된 치료를 유지하고 있었다.
치료를 중단한 주요 이유는 조혈모세포이식(아이클루시그 31% vs 이매티닙 37%), 이상반응(아이클루시그 12%, 이매티닙 12%), 효능 부족(아이클루시그 7% vs 이매티닙 26%) 등으로 보고됐다.
1차 유효성 분석 결과, 아이클루시그 투약군에서는 이매티닙 투약군의 17%(78명 중 17명)보다 두 배 더 높은 34%(154명 중 34명)의 환자가 미세잔존질환 음성 완전관해를 달성, 이매티닙을 압도했다.(P=0.0021)
세부적으로 미세잔존질환 0.01% 이하(MR 4)의 비율은 아이클루시그 투약군이 42%(154명 중 42명), 이매티닙 투약군은 21%(78명 중 16명)로 집계됐으며, 미세잔존질환 0.0032% 이하(MR 4.5)는 아이클루시그 투약군이 25%(154명 중 39명), 이매티닙군은 13%(78명 중 10명)으로 모두 아이클루시그 투약군이 이매티닙 투약군을 크게 상회했다.
2차 평가변수인 무사건 생존은 두 그룹 모두 중앙값이 이르지 않아 데이터가 충분히 완성되지 않았으나, 아이클루시그 투약군에서 더 개선된 흐름을 보였다.(HR=0.562, 95% CI 0.385-1.104)
치료 실패까지의 시간(Time to Treatment Failure, TTF) 역시 아이클루시그군에서 더 개선된 양상을 나타냈다.(HR=0.455)
안전성에 있어 3~4등급 및 5등급 이상반응 발현율은 두 그룹이 유사했으며, 동맥폐색 역시 두 그룹이 유사했다.
이와 관련, 연구진은 아이클루시그가 성인 Ph+ ALL 1차 치료에서 보다 깊고 지속적인 반응을 보였으며, 무사건 생존율은 개선되는 양상을 보였으며, 안전성은 유사했다고 총평했다.


