2곳은 뛰어들 준비...피험자 확보 용이한 해외로 눈 돌리기도
중앙방역대책본부가 8일 정례브리핑을 통해 이달 중 코로나바이러스감염증-19(코로나19) 항체치료제를 대량 생산할 수 있을 것으로 보인다고 밝혔다.
이날 중대본은 “현재 식품의약품안전처에서 임상 2상과 3상 시험계획을 심사 중이며, 9월 중에는 상업용 항체치료제를 대량생산할 계획”이라고 말했다. 그러면서 “항체치료제의 경우 국내 경증환자를 대상으로 하는 임상 1상도 별도로 승인받아 환자를 모집하고 있다”고 덧붙였다.
방역당국의 말은 곧바로 이슈가 됐다. 하지만 사실 이는 완전히 새로운 소식은 아니다.
코로나19 항체치료제 개발에 나선 ‘유일한’ 국내기업은 이미 지난 7월에 항체치료제 상업생산을 9월부터 시작하겠다고 밝혔다. 임상 1상 결과와 상관없이 우선 생산에 들어가고, 2상 시험에서 유효한 결과가 나오면 곧바로 긴급사용승인 절차를 밟겠다는 계획이었다.
그럼에도 이날 중대본의 브리핑 내용은 국내기업의 코로나19 치료제 개발 상황이 ‘계획대로’ 또는 ‘계획보다 더’ 진일보했다는 신호를 국민에게 준 것으로 해석할 수는 있다는 점에서 의미가 있다.

의약뉴스는 방역당국의 이번 브리핑을 계기로 국내 제약바이오기업의 코로나19 치료제 개발 동향을 점검해봤다.
식약처 임상시험정보를 살펴보면, 2020년 9월 8일 기준으로 코로나19 치료제 개발을 위한 임상시험을 승인받은 국내 제약바이오기업은 총 9개사다.
승인일이 빠른 순서대로 나열(괄호 안은 제품명)하면 ▲부광약품(레보비르캡슐) ▲엔지켐생명과학(EC-18) ▲신풍제약(피라맥스정) ▲종근당(CKD-314) ▲크리스탈지노믹스(CG-CAM20) ▲대웅제약(DWJ1248정) ▲셀트리온(CT-P59) ▲제넥신(GX-17) ▲GC녹십자(GC5153)다.
이 가운데 셀트리온은 8일 중대본이 언급한 ‘항체치료제’를 개발하고 있다.
셀트리온은 지난 7월 17일 항체치료제 ‘CT-P59’의 안전성ㆍ내약성ㆍ약동학을 평가하는 1상 계획을 식약처로부터 승인받은 후 임상을 완료했다. 현재 시험 결과를 분석 중이며, 동시에 2/3상 시험계획을 제출해 식약처 심사를 기다리고 있는 것으로 알려졌다.
따로, 지난달 25일에는 코로나19 경증환자를 대상으로 CT-P59의 안전성과 내약성을 평가하기 위한 임상1상 계획을 승인받고 현재 시험 대상자를 모집 중이기도 하다.
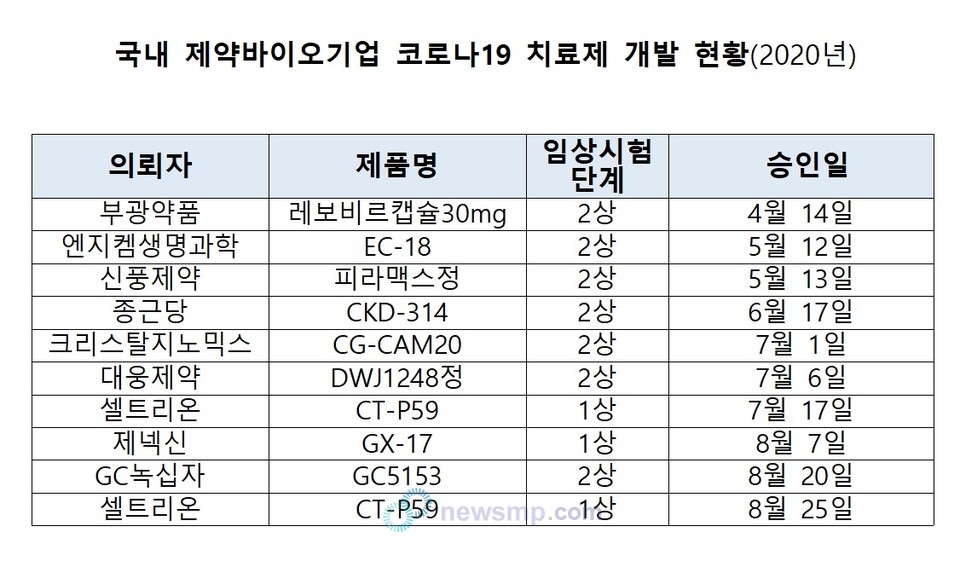
GC녹십자는 ‘GC5131’에 대한 임상시험을 지난달 20일 승인받았다. 이달 중 국내 6개 병원에서 환자를 모집해 2상 임상시험을 진행할 예정으로 전해졌다.
녹십자가 개발 중인 GC5131는 코로나19 ‘혈장분획치료제’다. 혈장분획치료제와 항체치료제는 코로나19 완치자의 혈액을 이용해 개발된다는 점에서는 같지만, 차이가 있다.
혈장분획치료제는 완치자의 혈장을 대량으로 수집한 후 분획과정 등을 거쳐 혈장에서 코로나 바이러스 중화능력을 보이는 항체를 정제ㆍ농축한 것이다. 항체치료제는 완치자의 혈액에서 바이러스 중화능력이 강력한 항체를 추출한 후 이를 세포에 주입해 대량 배양한 것이다. 생산비용이나 생산량 등에서 각각 장단점이 있다.
부광약품은 지난 4월 14일 자사의 항바이러스제 ‘레보비르30mg(성분명 클레부딘)’을 코로나19 치료제로 개발하기 위한 임상 2상을 승인받고, 현재 경북대병원 등 6개 병원을 통해 환자를 모집 중이다.
엔지켐생명과학은 코로나19 치료제 후보물질 ‘EC-18’의 임상 2상 승인을 지난 5월 12일 받고, 인하대병원 등 5개 의료기관을 통해 환자를 받기 시작했다.
신풍제약은 자사가 개발한 국내 16호 신약인 말라리아치료제 ‘피라맥스정’을 코로나19 치료제로 개발하기 위한 2상 시험 대상자를 연세의대세브란스병원 등 9개 병원에서 모집하고 있다.
이들 외에 종근당, 크리스탈지노믹스, 대웅제약은 임상시험 실시기관을 정해놓은 단계다. 제넥신의 경우 임상시험 실시기관을 아직까지 따로 정하지 않았다.

이처럼 국내 9개 제약사가 임상시험 승인을 받고 개발을 진행 중인 가운데, 동화약품도 지난달 19일 식약처에 코로나19 치료제 후보물질 ‘DW2008S’에 대한 2상 임상시험 승인을 신청하고 결과를 기다리고 있다.
DW2008은 동화약품이 천식치료제로 개발 중인 신약 후보물질인데, 동물효능시험 결과 항바이러스 효능이 확인돼 코로나19 치료제로서의 가능성을 알아보려는 상황이다.
또한, 한국유나이티드제약은 지난 6년간 천식 약으로 개발해온 흡입제 형태의 개량신약 ‘UI030’을 코로나19 치료제로 개발하겠다는 입장이다.
유나이티드제약은 ‘부데소나이드’와 ‘아포르모테롤’ 복합 개량신약 후보물질 ‘UI030’의 항바이러스 효능이 여러 차례 확인된 만큼 코로나19 치료용 임상을 국내에서 진행할 예정이라고 지난달 19일과 27일에 걸쳐 밝혔다.
한편, 종근당, 대웅제약, 한국유나이티드제약 등은 임상시험 피험자 확보가 용이하다는 이유 등으로 코로나19 치료제 개발을 위한 해외 임상시험을 추진하고 있기도 하다.
종근당은 러시아에서, 대웅제약은 인도와 필리핀에서 임상시험계획을 승인받았고, 유나이티드제약은 필리핀에서 임상시험을 추진한다는 계획이다.


