칼슘 조절 단백질 IP3R의 3차원 구조 밝혀내
아주대학교 약학대학 서민덕 조교수의 논문이 네이처 3월호에 게재됐다. 논문 주제는 인체 세포 내의 칼슘 농도를 조절하는 단백질인 IP3R의 3차원 구조를 규명해 각 Domain의 위치 및 기능과의 연관성을 밝힌 것이다.
우리 몸의 칼슘 이온은 세포의 생존에 필요한 다양한 생체 과정에서 중요한 역할을 하는데, 고농도의 칼슘은 세포에 독성을 나타내며, 비정상적인 칼슘 흐름은 심장병을 유발하기도 한다.
따라서 세포의 생존을 위해 칼슘 이온의 농도가 시간적, 공간적으로 매우 정교하게 조절돼야 하며, 이를 위해 수많은 단백질들이 다양한 기전을 통해 칼슘의 항상성을 유지하고 있다.
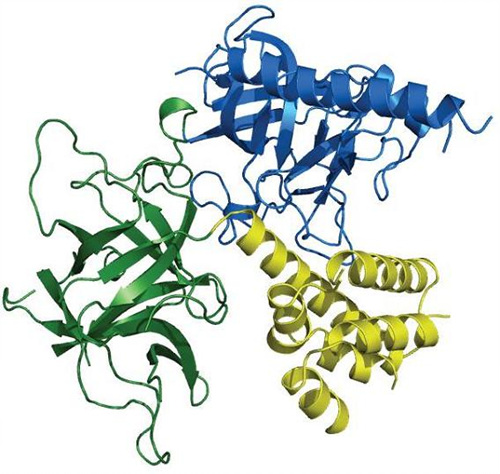 | ||
| ▲ IP3R N-말단의 3차원 구조. IP3R N-말단은 세 개의 Domain으로 구성되는데, 각각 다른 색깔(파란색, 녹색, 노란색)로 표시된 Domain들이 삼각형 형태로 배열돼있다. 이러한 모양의 배열이 IP3 결합 및 칼슘 채널의 기능에 중요한 역할을 한다. | ||
서 교수에 따르면 IP3가 결합했을 때와 IP3가 결합하지 않은 상태의 IP3R N-말단의 3차원 구조를 각각 규명해 비교한 결과, IP3 결합에 의한 단백질의 구조적인 변화가 채널의 기능과 연관돼있다는 것이다.
또한 IP3R N-말단에 IP3가 결합하면 마치 벌어졌던 조개가 닫히는 듯한 구조적인 변화가 일어나고 이를 통해 칼슘 채널이 열리는 것을 확인할 수 있었다고 밝혔다.
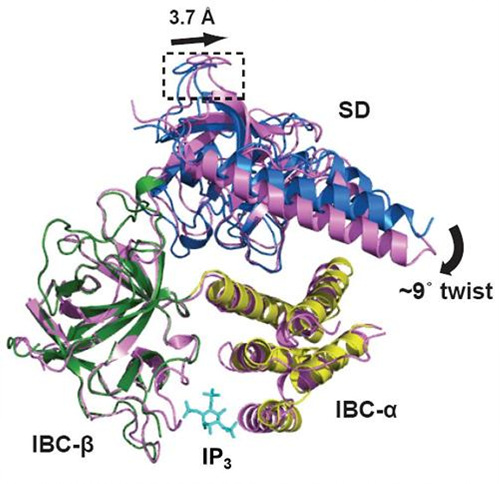 | ||
| ▲ 세 개(파란색, 녹색, 노란색)의 Domain으로 구성된 IP3R N-말단에 IP3가 결합했을 때(분홍색)의 IP3R N-말단의 3차원 구조 비교. IP3 결합에 의해 발생한 단백질의 구조적인 변화가 칼슘 채널이 열리는 데 필수적인 역할을 한다. | ||
논문에 따르면 두 가지 모두 구조적으로나 기능적으로 유사하며, 중요한 Domain을 서로 바꿨을 때에도 정상적인 채널의 기능을 보인다는 것을 다양한 기능 실험을 통해서 규명했다.
서 교수는 “이러한 구조-기능 상관관계에 대한 연구를 통해 비슷한 기능을 하는 서로 다른 칼슘 채널들이 유사한 기전에 의해 기능할 것으로 예상된다.”면서 “이는 다양한 이온 채널들의 관련 연구에 커다란 기여를 할 것으로 예상된다.”고 전했다.
이처럼 칼슘 방출을 위해 필수적인 역할을 한다고 알려진 IP3R N-말단 지역의 3차원 구조가 밝혀지면서 각 Domain의 위치와 배열이 기능적으로 어떻게 연관되는지(구조-기능의 상관관계), 나아가 인체 내 칼슘 항상성에 문제가 생겨 발생하는 질병들을 타겟으로 하는 약물 개발의 기반을 마련하는 데에도 큰 도움이 될 것으로 전망된다.
한편 이번 논문은 서 교수의 박사후연수 시절의 지도 교수인 캐나다 토론토 대학교의 Mitsu Ikura 교수와 영국 캠브리지 대학의 Colin Taylor 교수와의 공동연구로 진행됐다.
저작권자 © 의약뉴스 무단전재 및 재배포 금지


