[의약뉴스 in 마드리드] 다이이찌산쿄가 향체약물접합제(Antibody-Drug Conjugates, ADC) 시장에서 리더십을 공고히하고 있다.
최근 ADC 분야에서 MSD와의 협업을 발표한 가운데 21일 진행된 유럽종양학회 연례학술회의(ESMO Congress 2023)에서는 다이이짜산쿄가 개발하고 있는 3가지 항체약물 접합체의 연구 결과가 연이어 발표됐다.
먼저 TROP-2 ADC Dato-Dxd(다토포타맙-데룩스테칸)은 삼중음성유방암에서 항PD-L1 면역항암제 임핀지(성분명 더발루맙, 아스트라제네카)와 시너지를 확인했다.
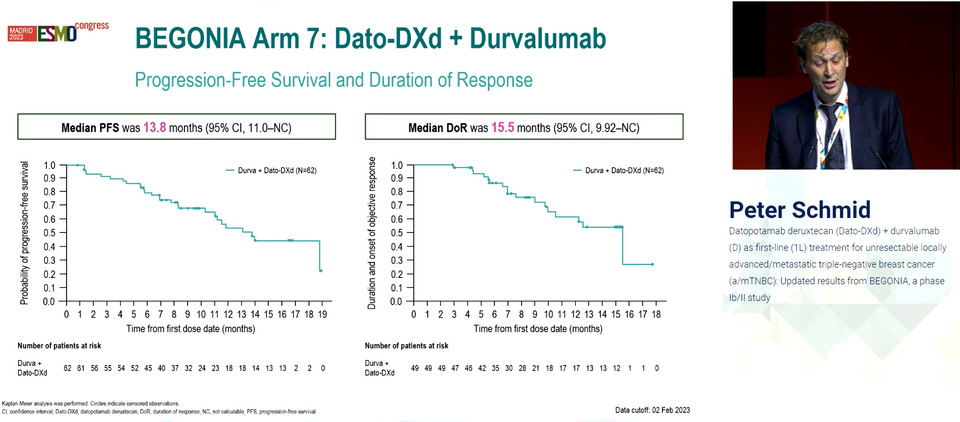
절제불가능한 전이성/진행성 삼중음성유방암 환자를 대상으로한 레이블 공개 임상 2상에서 긍정적인 결과를 도출한 것.
총 62명을 대상으로 Dato-Dxd와 임핀지를 병용한 결과, PD-L1이나 TROP2 발현여부에 상관없이 높고 지속적인 반응이 나타난 것.
내장전이 환자가 60%, PD-L1 저발현 환자가 87%에 이르는 가운데 10%(6명)의 완전반응(Complete Response, CR) 포함, 객관적반응률(Objective Response Rate, ORR)이 79%에 달했다.
반응은 PD-L1 발현 정도에 상관없이 나타났으며, 반응지속기간(Duration of Response, DoR, 이하 중앙값) 15.5개월, 무진행생존기간(Progression-Free Survival, PFS)은 13.8개월로 집계됐다.
3/4등급 이상반응은 57%, 심각한 이상반응은 14%에서 보고됐으나, 치료와 관련한 이상반응으로 사망한 환자는 없었고, 16%가 치료 약물 중 하나 이상을 원인으로 치료를 중단했다.
결과적으로 이상반응은 관리가 가능한 수준이었으며, 유망한 반응을 보였다는 평가다.
HER3 ADC HER-Dxd(파니투무맙-데룩스테칸)은 HERTHENA-Lung01 연구의 중추신경계 효과에 대한 분석 결과가 발표됐다.
HERTHENA-Lung01는 이전에 TKI(Tyrosine Kinase Inhibitor)와 백금기반 항암화학요법을 모두 사용한 EGFR 양성 진행성 비소세포폐암환자 225명을 대상으로 진행하고 있는 레이블 공개 임상 2상이다.
앞서 지난달 진행된 세계폐암학회 연례학술회의(ESMO 2023)에서 발표된 HERTHENA-Lung01 연구의 중간분석에서 HER3-Dxd의 객관적 반응률이 28.4%, 질병조절률이 73.3%, 반응지속기간은 6.0개월, 무진행생존기간은 5.5개월로 보고됐다.
가용한 치료제를 모두 소진한 환자들이었던 만큼, 상당히 고무적인 결과였다.
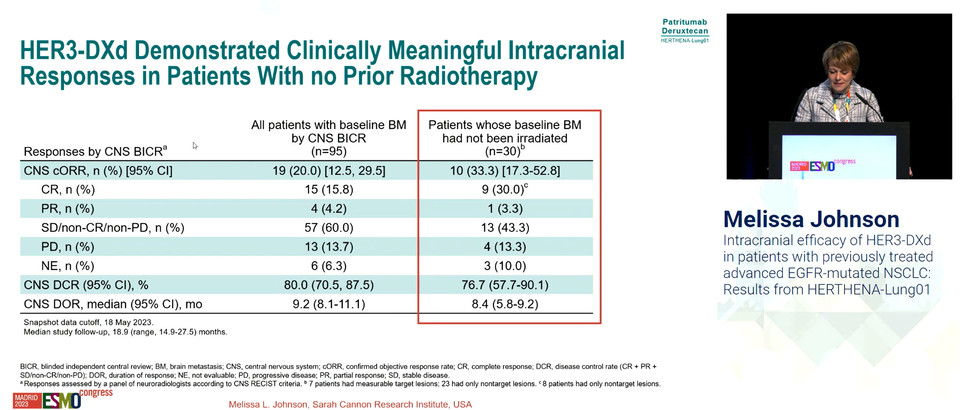
이 가운데 22일 발표된 추가 분석은, 기저시점에 뇌전이가 있었던 환자들에 대한 분석 결과로, 완전반응 15.8% 포함 객관적 반응률이 20.0%, 반응지속기간은 8.5개월로 보고됐다.
뇌전이와 관련 HER3-Dxd 투약 전 6개월 이내에 방사선 치료를 받은 환자에서는 완전반응 8.3% 포함 객관적반응률이 13.9%, 6개월 이전이 방사선 치료를 받은 환자에서는 완전반응 6.9% 포함 객관적반응률이 10.3%, 방사선 치료를 받지 않은 환자에서는 완전반응 33.3% 포함 객관적 반응률이 36.7%로 집계됐다.
반응지속기간은 6개월 이내에 방사선 치료를 받은 환자에서는 중앙값에 이르지 않았고, 6개월 이전에 받은 환자는 8.1개월, 받지 않은 환자는 8.4개월로 보고됐다.
전신요법의 효과를 기대하기 어려운 뇌전이 환자에서도 지속적인 반응이 나타났다는 평가다.
다이이찌산쿄의 ADC 분야 선두주자 엔허투(성분명 트라스투주맙데룩스테칸)은 폐암환자를 대상으로 평가한 DESTINY-Lung01 및 DESTINY-Lung02 연구의 뇌전이 여부에 따른 통합 분석과 다양한 고형암 환자를 포함해 분석한 DESTINY-PanTumor01 연구 결과가 연이어 공개됐다.
DESTINY-Lung01 및 DESTINY-Lung02 연구의 통합분석에서는 엔허투 5.4mg/kg 투약군과 6.4mg/kg 투약군으로 구분해 평가했다.
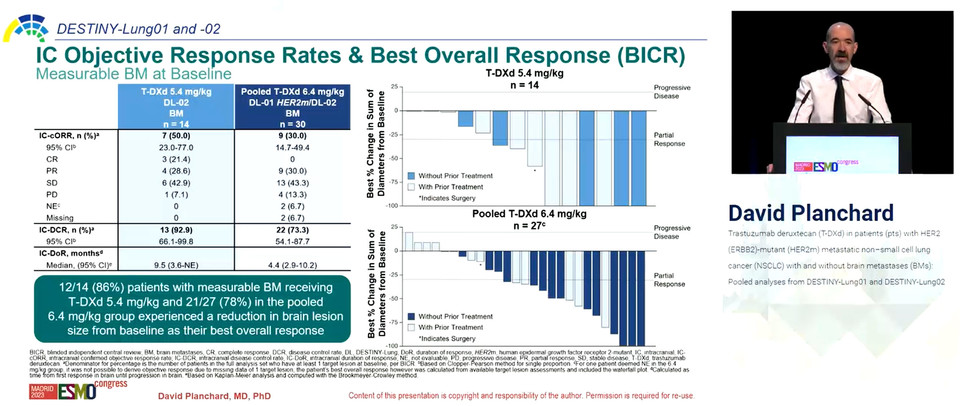
5.4mg/kg 군에서는 뇌전이 환자에서 객관적반응률이 46.9%, 질병조절률이 90.6%로 뇌전이가 없는 환자의 50.0%, 94.3%와 큰 차이를 보이지 않았으나 반응지속기간은 뇌전이가 있는 환자가 4.6개월, 없던 환자는 16.8개월로 상당한 차이를 보였다.
6.4mg/kg 군 역시 뇌전이가 있는 환자에서 객관적반응률이 50.0%, 질병조절률은 92.6%로 뇌전이가 없는 환자의 58.6%, 92.0%와 큰 차이가 없었으나, 반응지속기간은 뇌전이가 있는 환자가 7.2개월, 뇌전이가 없던 환자는 14.1개월로 적지 않은 차이를 보였다.
뇌전이가 있던 환자 중 5.4mg/kg 투약군은 두개내 객관적반응률이 25.0%, 두개내 질병조절률은 81.3%, 두개내 무질병생존율은 9.2개월로 집계됐으며, 6.4mg/kg 투약군은 두개내 객관적반응률이 18.5%, 질병조절률은 7.4%, 무진행생존율은 4.4개월로 집계됐다.
이전에 전신요법에 실패한 HER2 음성 고형암 환자를 대상으로 발표한 분석에서 엔허투 5.4mg/kg 3주 1회 요법을 평가한 DESTINY-PanTumor01에서는 유방암에서 50.0%, 직작암에서 20.0%, 두경부암과 난소암 66.7% 등 다양한 암종에서 긍정적인 결과를 제시했다.


