[의약뉴스 in 마드리드] 난공불락의 위/위식도접합부위암에도 조금씩 변화가 찾아오고 있다.
옵디보(성분명 니볼루맙, BMSㆍ오노)에 이어 키트루다(성분명 펨브롤리주맙, MSD)가 위/위식도접합부위암에서 긍정적인 결과를 만들어낸 가운데, 21일 오후(현지시간) 유럽종양학회 연례학술회의(ESMO Congress 2023)에서는 캄렐리주맙과 티스렐리주맙, 졸베툭시맙 등 면역항암제 후발주자들의 데이터가 연이어 공개됐다.
◇캄렐리주맙, 리보세라닙과 시너지
중국 항서제약의 면역항암제 캄렐리주맙은 국내 바이오업체 HLB의 VEGFR-2 억제제 리보세라닙과의 병용요법으로 간암에 이어 위암에서도 성과를 도출했다.
앞서 지난해 유럽종양학회 연례학술회의에서는 절제불가능한 진행성 간암에서 리보세라닙과 캄렐리주맙 병용요법이 소라페닙(오리지널 제품며 넥사바, 바이엘)을 넘어섰다는 연구결과를 발표한 바 있다.
21일 공개된 DRAGON IV 연구에서는 절제 가능한 위/위식도접합부위암 환자에서 수술 전 보조요법으로 리보세라닙과 캄렐리주맙, 항암화학병용요법을 항암화학단독요법과 비교했다.
총 360명의 환자를 1대 1로 무작위 배정해 진행한 이 연구에서 실험군(리보세라닙+캄레리주맙+항암화학)은 179명이 수술 전 보조요법을 시행해 164명이 완료, 155명이 수술로 이어졌다.
대조군(항암화학 단독)은 177명이 수술 전 보조요법을 시행해 169명이 완료했으며, 156명이 수술로 이어졌다.
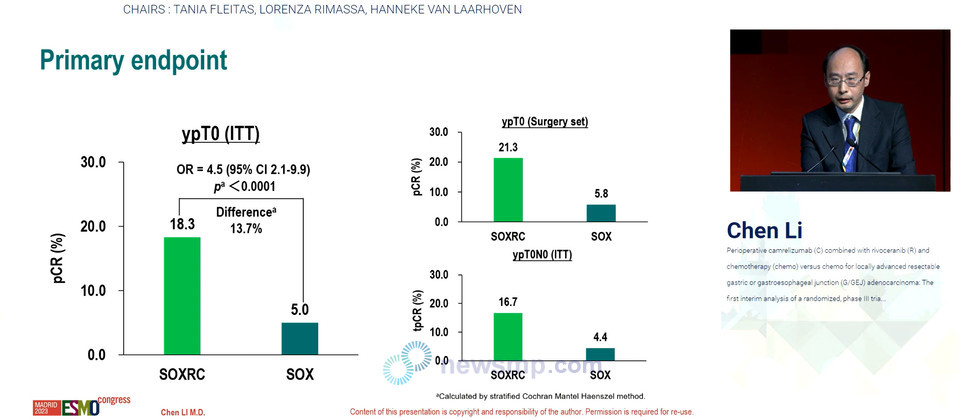
이 가운데 독립적 검토위원회가 평가한 실험군의 병리학적 완전관해율(pathological Complete Response, pCR)이 18.3%로 5.0%에 그친 대조군보다 13.7%p 개선했다.(95% CI 7.2-20.1, P<0.0001)
주요 병리학적 반응률(Major Pathological Response, MPR)은 51.1%와 37.8%, 전체 병리학적 완전관해율(total pathological Complete Response, tpCR)은 16.7%와 4.4%로 모두 실험군이 더 높았다. 또한 완전절제율(R0)도 실험군이 98.7%로 대조군의 94.2%를 상회했다.
◇티스렐리주맙, 항암화학요법과 시너지
베이진의 PD-1 항체 티스렐리주맙은 HER2 음성 진행성 위/위식도 접합부위암에서 항암화학요법과 시너지를 확인했다.
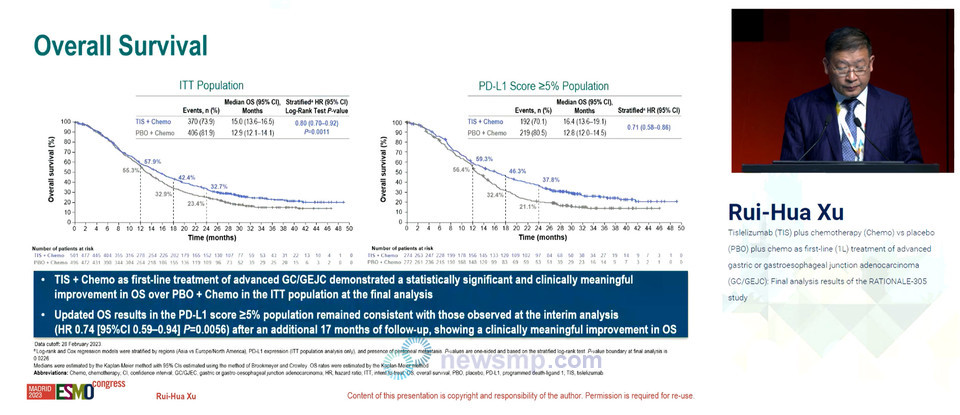
총 997명의 환자를 1대 1로 무작위 배정해 티스렐리주맙과 항암화학 병용요법을 항암화학 단독요법과 비교한 RATIONALE-305 3상 임상의 최종 분석 결과, 전체 환자군에서 티스렐리주맙 병용요법군의 전체생존율(Overl Survival, OS)이 15.0개월로 항암화학 단독요법의 12.9개월과 비교해 사망의 위험을 20% 줄였다.(HR=0.80, 95% CI 0.70-0.92, P=0.0011)
무진행 생존기간(Progression-Free Survival, PFS) 중앙값은 6.9개월과 6.2개월로 티스렐리주맙 병용요법군의 질병 진행 또는 사망의 위험이 22% 더 낮았다(HR=0.78, 95% CI 0.67-0.90).
객관적반응률(Objective Response Rate, ORR)은 47.3%와 40.5%, 반응지속기간(Duration or Response, DoR) 중앙값은 8.6개월과 7.2개월로 집계됐다.
◇졸베툭시맙, CLDN18.2 양성 위암에서 긍정적 결과
아스텔라스의 졸베툭시맙은 CLDN18.2 양성, HER2 음성 위/위식도접합부위암 환자에서 긍정적인 결과를 만들어가고 있다.
21일에는 국소 진행성 위/위식도접합부위암 환자의 1차 치료에서 각각 CAPIX요법과 mFOLFOX6요법에 졸베툭시맙을 추가한 GLOW 및 SPOTLIGHT 3상 임상 결과가 연이어 발표됐다.
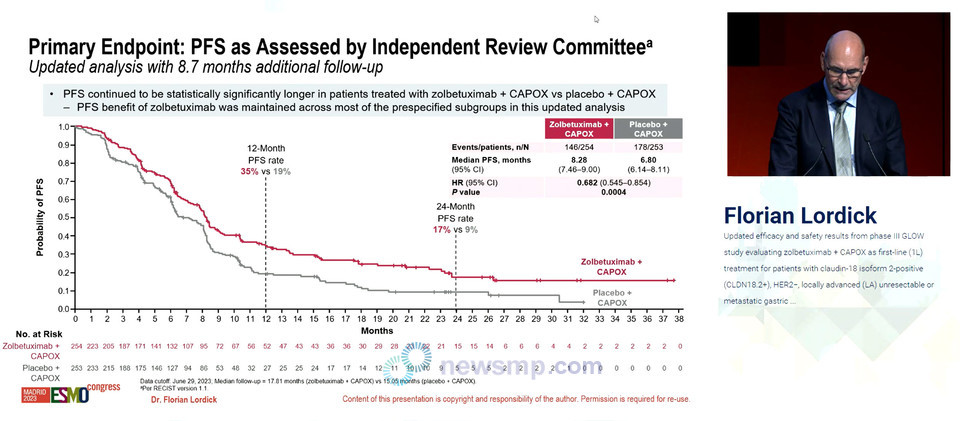
먼저 GLOW 3상에서는 졸베툭시맙과 CAPOX 병용요법군의 무진행 생존기간 중앙값이 각각 8.3개월과 6.8개월로 졸베툭시맙군의 질병 진행 또는 사망의 위험이 32% 더 낮았다.(HR=0.68, 95% CI 0.55-0.85, P=0.0004)
전체생존기간 중앙값 역시 14.3개월과 12.2개월로 졸베툭시맙군의 사망 위험이 23% 더 낮았다.(HR=0.77, 95% CI 0.62-0.95, 0.0079) 24개월 전체생존율은 각각 28.3%와 18.8%로 집계됐다.
SPOTLIGHT 3상 연구에서도 동일한 양상이 이어졌다. 졸베툭시맙과 mFOLFOX6 병용요법군의 무진행생존기간 중앙값이 10.6개월로 mFOLFOX6 단독요법의 8.7개월보다 질병진행 또는 사망의 위험이 25% 더 낮았다.(HR=0.75, 95% CI 0.60-0.94, 95% CI 0.0066)
전체생존기간 중앙값 역시 18.2개월과 15.5개월로 졸베툭시맙군의 사망 위험이 25% 더 낮았다.(HR=0.75, 95% CI 0.60-0.95, P=0.0053)


