면역항암제ㆍVEGF-TKI 노출 환자에서 객관적반응률 47%
[의약뉴스] MSD의 경구용 저산소증유도인자-2 알파(HIF-2α) 억제제 웰리렉(성분명 벨주티판)이 신세포암 분야에서 데이터를 확대하고 있다.
15일(현지시간) 미국임상종양학회 비뇨생식기암 심포지엄(ASCO GU 2025)에서는 이전에 PD-1 또는 PD-L1 면역항암제와 VEGF-TKI 치료이후 질병이 진행한 국소 진행성 도는 전이성 투명세포 신세포암 환자를 대상으로 진행한 KEYMAKER-U03 Substudy 03B 1/2상 중 B4, B5 및 참조군에 대한 데이터가 공개됐다.
이 가운데 B4는 키트루다(성분명 펨브롤리주맙, MSD)와 웰리렉 병용요법, B5는 렌비마와 웰리렉 병용요법, 참조군은 키트루다와 렌비마 병용요법으로 치료를 받았다.
키트루다와 웰리렉 병용요법군에는 62명, 렌비마와 웰리렉 병용요법군에는 64명, 키트루다와 렌비마 병용요법군에는 73명이 배정됐다.
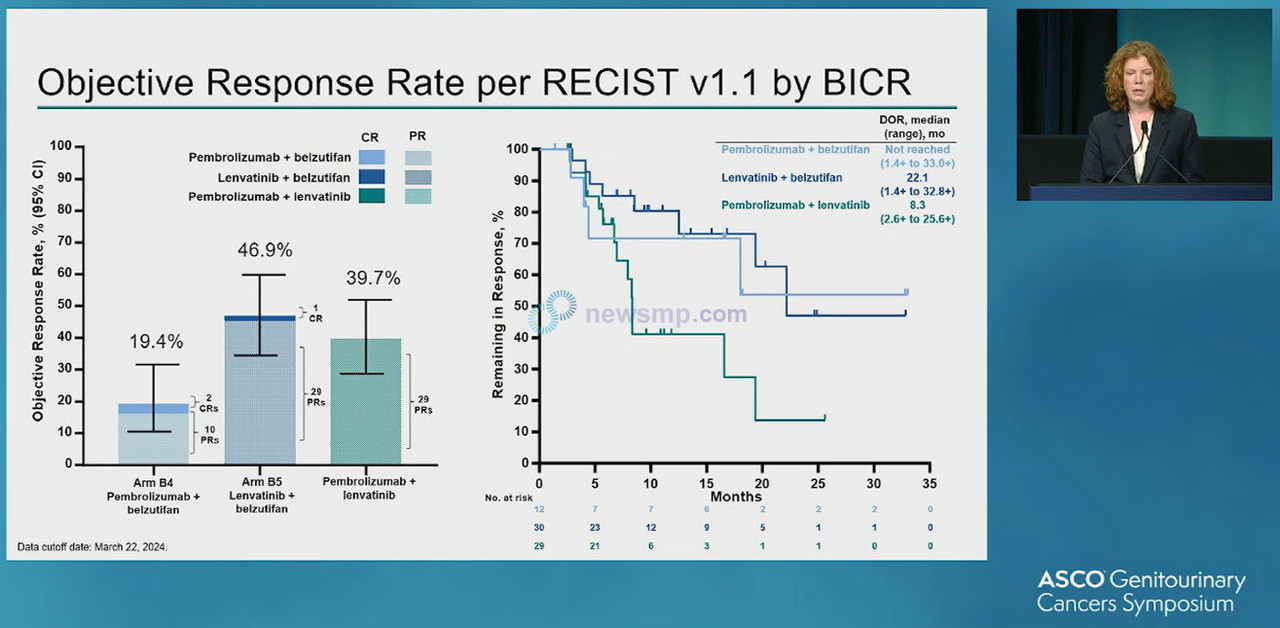
15일 발표된 연구 결과는 키트루다와 웰리렉 병용요법군의 중앙 추적관찰 기간이 16.6개월, 렌비마와 웰리렉 병용요법군은 17.6개월, 키트루다와 렌비마 병용요법군은 19.4개월 시점에 분석했다.
분석 결과 객관적반응률(Objective Reponse Rate, ORR)은 키트루다와 웰리렉 병용요법군에서 2명의 완전반응(Complete Reponse, CR)을 포함, 19.4%에 그쳤으나, 렌비마와 웰리렉 병용요법은 1명의 완전반응 포함 46.9%로 참조군인 키트루다와 렌비마 병용요법은 39.7%를 상회했다.
반응지속기간(Duration of Response, DoR)은 키트루다와 웰리렉군이 중앙값에 이르지 않은 가운데 렌비마와 웰리렉군은 22.1개월, 키트루다와 렌미바군은 8.3개월로 집계됐다.
종양 크기 변화에 있어서 키트루다와 웰리렉군은 평가 가능한 59명 중 39명(66.1%)에서 종양의 크기가 줄어들었으며, 59명 중 17명(28.8%)는 30% 이상 감소했다.
렌비마와 웰리렉 군은 평가 가능한 60명 중 53명(88.3%)에서 종양의 크기가 줄어들었고, 60명 중 36명(60.0%)이 30% 이상 감소했다.
키트루다와 렌비마 병용요법군은 평가 가능한 73명 중 67명(91.8%)에서 종양의 크기가 감소한 가운데, 73명 중 36명(49.3%)은 30% 이상 줄어들었다.
6, 12개월 무진행 생존율은 키트루다와 웰리렉 병용군이 418%와 28.6%, 렌비마와 웰리렉 병용군이 63.1%와 51.8%, 키트루다와 렌비마 병용군은 66.7%와 34.5%로 집계됐으며, 무진생행존기간 중앙값은 각각 5.4개월과 12.5개월 9.4개월로 보고됐다.
12, 18개월 전체생존율은 키트루다와 웰리렉 병용군이 67.9%와 57.6%, 렌비마와 웰리렉 병용군은 79.5%와 74.4%, 키트루다와 렌비마 병용군은 81.7%와 73.2%로 집계됐다.
전체생존기간 중앙값은 키트루다와 웰리렉 병용군이 27.4개월, 렌비마와 웰리렉 병용군은 32.3개월로 보고됐으며, 키트루다와 렌비마 병용군은 중앙값에 이르지 않았다.
안전성에 있어 치료와 관련한 3등급 이상의 이상반응은 키트루다와 웰리렉 병용군에서 41.9%, 렌비마와 웰리렉 병용군은 60.3%, 키트루다와 렌비마 병용군은 49.3%에서 보고됐다.
치료와 관련한 이상반응으로 인해 어느 약이건 중단한 환자는 각각 11.3%와 9.5%, 12.3%로 집계됐다.
키트루다와 웰리렉 병용군에서는 치료와 관련한 이상반응으로 인해 사망한 환자가 보고되지 않았으며, 렌비마와 웰리렉 병용군에서는 2명, 키트루다와 렌비마 병용군에서는 1명이 보고됐다.
이와 관련, 연구진은 렌비마와 웰리릭 병용요법이 46.9%라는 수치적으로 높은 객관적 반응률과 12.5개월의 무진행생존기간 중앙값에 관리 가능한 안전성을 보고했다면서 이전에 2차례 이상 치료를 받은 국소 진행성 또는 전이성 투명세포 신세포암 환자에서 임상적으로 유망한 항종양 활성을 보였다고 의미를 부여했다.
아울러 키트루다와 렌비마 병용요법도 이러한 환자에서 항종양 활성을 보였으며, 키트루다오 웰리렉의 결과는 이전에 LITESPARK-005 3상 임상에서 보고된 웰리렉 단독요법과 유사하다고 평가했다.
LITESPARK-005는 면역항암제(PD-1 또는 PD-L1 억제제) 및 VEGF-TKI 치료 후 질병이 진행된 진행성 투명세포 신세포암 환자를 대상으로 웰리렉 단독요법을 기존의 표준요법인 에베로리무스와 비교한 3상 임상으로, 이 연구에서 웰리렉은 에베로리무스 대비 무진행생존율과 객관적반응률을 개선, 2023년 미국 FDA로부터 신장암 치료제로 승인을 받았다.


