[의약뉴스] 노바티스의 방사성의약품 루타테라(성분명 루테튬옥소도트레오타이드액, 177Lu-DOTATATE)가 진행성 위ㆍ장ㆍ췌장계 신경내분비종양(GEP-NETs) 1차 치료 성적을 크게 개선했다.
19일(현지시간) 미국임상종양학회 소화기암 심포지엄(ASCO GI)에서는 2ㆍ3등급 분화 진행성 위ㆍ장ㆍ췌장계 신경내분비종양 환자의 1차 치료로 루타테라와 장기 지속형 옥트레오티드 병용요법을 옥트레오티드 단독요법과 비교한 NETTER-2 3상 임상 결과가 공개됐다.
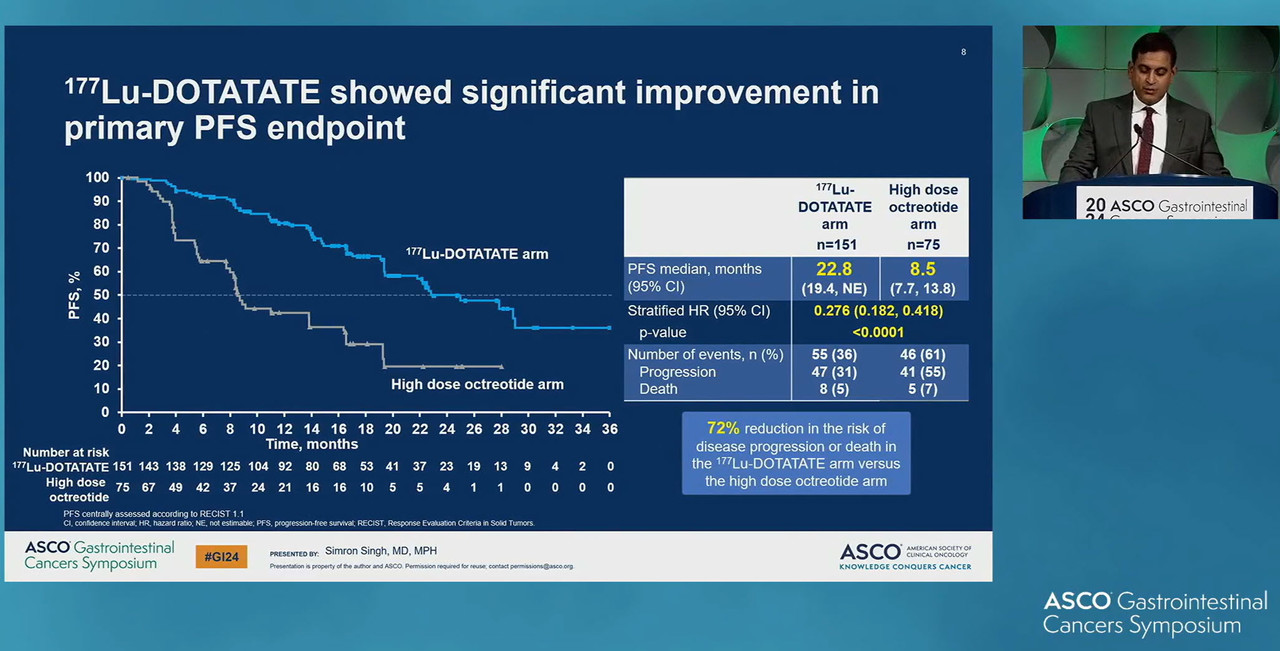
앞서 지난해 9월, 노바티스는 이 연구에서 1차 평가변수를 충족했다는 탑-라인 리포트를 발표한 바 있다.
NETTER-2는 총 226명의 환자를 대상으로 진행됐으며, 환자들은 실험군과 대조군에 2대 1로 무작위 배정돼 실험군에서는 8주 간격으로 루타테라(4 × 7.4GBq)와 옥트레오티드 30mg을 4주기간 투약한 후 4주 간격으로 옥트레오티드를 투약했으며, 대조군은 4주 간격으로 옥트레오티드 60mg을 투약했다.
1차 평가변수는 무진행생존율(Progression-Free Survival, PFS), 2차 평가변수는 객관적반응률(Objective Response Rate, ORR)로 정의했다.
연구에 참여한 환자 중 절반 이상(54.4%)이 췌장에서 종양이 발생했으며, 소장(29.2%)이 그 뒤를 이었고, 등급별로는 3등급이 35.0%를 차지했다.
실험군에서 루타테라 누적 용량 중앙값은 29.2GBq였으며, 87.8%의 환자가 초기 4주기 투약을 마무리했다.
1차 평가변수인 무진행생존기간 중앙값은 실험군이 22.8개월로 대조군의 8.5개월과 비교해 14.3개월을 연장, 두 배 이상 늘었으며, 질병 진행 또는 사망의 위험은 약 78% 적었던 것으로 나타났다.(HR=0.276, 95% CI 0.182-0.418, P<0.0001)
객관적반응률은 실험군이 43.0%로 대조군의 9.3%를 크게 상회했으며, 통계적으로 의미있는 차이를 보였다.(Odds Ratio=7.81, 95% CI 3.32-18.4, P<0.0001)
이 같은 양상은 사전에 지정한 모든 하위그룹에서 일관된 경향을 보였다.
안전성에 있어 실험군에서 3~4등급 백혈구감소증, 빈혈 및 혈소판감소증은 각각 3명 이하에서 발생했으며, 골수형성이상증후군은 1명에서 보고됐다.
연구진은 이 연구가 모든 악성 종양의 1차 치료에서 방사성의약품의 효능을 입증한 최초의 무작위 대조 임상으로, 향후 임상 관행을 바꿀 것이라 의미를 부여했다.


