[의약뉴스] 식품의약품안전처(처장 오유경)가 제약사에 요구한 불순물 조사 자료 제출 기한이 마감돼 귀추가 주목된다.

식약처는 제출받은 자료를 분석해 지난 2018년 이후 해마다 발생하고 있는 니트로사민류 불순물(NDMA)이 어디에서, 어떻게, 왜 검출되는지 검토하고 예방책을 마련할 계획이다.
앞서 식약처는 국내 제조ㆍ수입업체를 통해 각사의 원료의약품 및 완제의약품(합성의약품)에 대해 원료와 제조공정 등을 검토, NDMA가 발생할 수 있는지 평가한 후 관련 자료를 지난 5월 31일까지 제출하도록 했다.
그러나 일부 업체들은 코로나19로 인해 기한 내에 해외 제조소의 자료를 넘겨받기가 어렵고, 시험법 개발과 시험센터 섭외에도 문제가 있다며 제출 기한 연장을 요구했다.
이에 식약처는 해외제조원 자료 확보와 시험범 개발 등에 어려움을 겪는 제약사는 품목별 연장 사유와 기간 등을 명시해 연장요청을 하면 개별 승인하겠다고 밝혔다.
식약처 관계자는 “5월 31일 현재 계속해서 업체들로부터 서류가 들어오고 있다”며 “구체적인 자료 제출 현황은 아직 공개하기 어렵다”고 전했다.
이어 “서류 제출에 어려움을 호소한 업체들이 있었기에 오늘까지 연장신청을 하는 곳들도 있었다”며 “5월 31일까지 대부분 자료 제출 혹은 연장신청을 완료할 것으로 보고 있다”고 밝혔다.
식약처는 제출된 자료의 검토를 마치고 최대한 신속하게 안전조치에 나선다는 방침이다.
이 관계자는 “개별 품목에 대한 제출자료 검토 및 해당 성분 의약품에 대한 종합적인 검토도 병행해야 한다”며 “이외에도 불순물 관리 기준 설정 등은 해외 규제기관과 공조가 필요하다”고 말했다.
이어 “아직 정확하게 제출된 자료를 검토하는데 얼마나 시간이 걸릴지 말하기는 어렵다”며 “그러나 가급적이면 신속하게 불순물 관련 안전조치를 취하려 한다”고 전했다.
불순물 조사 결과에 따라서는 행정조치 가능성도 열려있다.
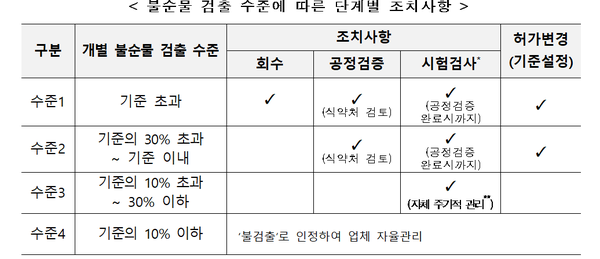
이 관계자는 “1일 섭취 허용기준을 초과해 불순물이 검출된다면 회수 대상으로 분류하려 한다”며 “기준 아래로 검출됐더라도 식약처에서 정한 처리방안에 따라 시정ㆍ예방 조치를 취해야 한다”고 밝혔다.
다만 "시설에 관한 규정 강화 등의 계획은 없다”면서 “이번 자료 제출 과정에서 업계와 지속적으로 소통해왔으며, 앞으로도 필요한 사항이 있다면 언제라도 업계와 소통해 업무를 진행하겠다”고 전했다.


