◇한국의약품수출입협회, 회원사 AEO 공인획득 지원

한국의약품수출입협회가 회원사의 관세청 수출입안전관리 우수업체(AEO) 공인 획득을 지원하기 위해 한국관세무역개발원과 업무협약(MOU)을 체결했다.
AEO(Authorized Economic Operator)란 수출입업체, 운송인, 창고업자, 관세사 등 무역과 관련된 업체들 중 관세청이 법규준수, 안전관리 수준 등을 심사한 뒤 수출입안전관리우수업체로 공인한 업체를 의미한다.
AEO로 선정된 기업은 신속통관, 세관검사 축소 등 관세행정 절차상 간소화 혜택을 받는다.
또한, 우리나라와 AEO 상호인정협정(MRA)을 체결한 상대국 세관에서도 동등한 혜택을 누릴 수 있다.
대신 사회안전, 국민건강을 위협할 수 있는 물품의 반입을 차단하도록 노력해야 한다.
지난 3일 체결한 업무협약에 따라 한국의약품수출입협회에서 추천한 업체는 한국관세무역개발원으로부터 AEO 공인획득을 위한 신청 및 실사, 컨설팅 등의 지원을 받을 수 있게 된다.
한국의약품수출입협회 백승열 회장은 “이번 업무협약 체결로 보다 많은 협회 회원사가 AEO제도를 보다 쉽게 이용할 수 있게 되고, 나아가 안전하고 원활한 국제무역에 기여할 것으로 기대한다”고 말했다.
◇동아ST, 척추측만증 보조기 ‘스파이나믹(Spinamic)’ 국ㆍ내외 독점판매 계약 체결

동아에스티(대표이사 사장 한종현)는 국내 척추 솔루션 기업 ‘VNTC(VALUE AND TRUST, 밸류앤드트러스트, 대표 노경석)’와 척추측만증 보조기 ‘스파이나믹(Spinamic)’ 국내외 독점판매 계약을 체결했다고 7일 밝혔다.
계약에 따라 동아에스티 의료기기사업부와 해외사업부가 국내외 유통망을 활용해 스파이나믹을 판매해 나갈 계획이다.
스파이나믹은 경성 보조기의 교정 원리와 연성 보조기의 편의성을 겸비한 의복형 하이브리드 보조기다. 플라스틱형 보조기 착용이 어려워 방치되고 있는 경증 단계 환자부터 성인 및 장애 환자까지 넓은 범위에서 착용 가능하다.
경성 보조기와 동일하게 Deflexion(역휨), Derotation(역회전), Elongation(신장력)의 필수 교정 원리를 다양한 밴드 및 패드로 구현하고 있으며, 다이얼 장치를 조여 환자의 병증 개선에 따라 압박 강도를 조절할 수 있는 것이 특징이다.
이에 따라 청소년의 성장 상태에 따라 커스터마이징이 가능하다. 분리가 가능하기 때문에 세탁도 가능하다.
또한, 심미적 디자인으로 환자에게 시각적 부담감을 줄이고, 심리적 안정감을 주어 쾌적한 착용감으로 일일 18시간으로 권장되는 착용 시간을 환자가 준수할 수 있도록 도와준다.
플라스틱 보조기는 환자의 몸에 석고로 본을 떠 만들기에 제작 기간이 최소 2주 이상 소요되지만, 스파이나믹 보조기는 X-ray 촬영, 치수 측정, 제품 조절 등의 맞춤 제작 과정을 거쳐 1~2일 내로 제작할 수 있다.
척추측만증은 척추가 옆으로 휘어지는 질환이다. 업계에 따르면 국내 전체 인구의 약 4%가 척추측만증을 앓고 있고, 척추측만증 환자 중 약 44%가 성장기 청소년인 것으로 추산하고 있다. 척추측만증은 장기간에 걸쳐 경증, 중등증, 중증으로 발전하며, 방치 시 흉터와 부작용이 남는 수술을 시행해야 하므로 초기부터 적극적인 치료가 필요하다.
척추측만증 보조기 시장 규모는 국내 1300억 원, 일본 7100억 원, 미국 4조 7000억 원, 중국 5조 4000억원에 달하는 것으로 업계는 추산하고 있다.
동아에스티 관계자는 “스파이나믹은 경성 보조기와 연성 보조기의 장점을 두루 갖췄으며, 특히 청소년들의 성장 상태에 따라 맞춤 조절이 가능하다는 장점도 갖췄다”면서 “척추측만증으로 고통받는 환자들의 보다 나은 일상생활을 위해 스파이나믹이 도움이 됐으면 좋겠다”고 말했다.
한편, 동아에스티 의료기기사업부는 심장수술용 인공판막, 유착방지제 등의 의료용 임플란트 부문과 동맥경화진단기, 전기수술기, 체외충격파 쇄석기, 양성자 치료장비 등의 의료장비 부문의 사업을 전개하고 있다.
◇한미약품 항암신약 4종, 미국임상종양학회(ASCO)서 연구결과 발표
한미약품이 개발한 항암신약의 상용화 개발을 진행 중인 파트너사들이 지난 4일부터 온라인으로 개최된 2021 미국임상종양학회(ASCO)에서 주요 임상 연구결과를 구연 및 포스터로 발표했다.
파트너사 스펙트럼은 EGFR 또는 HER2 Exon20 돌연변이를 가진 비소세포폐암(NSCLC) 환자에서 포지오티닙의 중추신경계(CNS) 활동에 대한 결과를 포스터로 발표했다.
발표 된 ZENITH20 임상은 EGFR과 HER2 Exon20 삽입 비소세포폐암 환자를 모집한 글로벌 임상으로, 코호트 1,2와 3에서 총 284명 환자 중 뇌전이를 가진 36명의 환자의 결과를 평가했다.
평가된 36명의 환자들은 초기모집단계(Baseline)에서부터 독립적인 연구소에서 검증한 전이 뇌종양을 가지고 있었으며, 이 중 8%에 해당하는 3명의 환자에서 완전관해(CR, Complete Response)를 보였다.
뇌종양은 비소세포폐암 환자의 최고 25%에서 흔히 발생하는 전이로, 짧은 생존기간과 관련이 있다. 환자들은 포지오티닙16mg을 1일 1회 투여받았다.
스펙트럼 최고의학책임자 프랑수아 레벨은 “중추신경계(CNS) 전이는 비소세포폐암 환자에서 흔하고 생명을 위협하는 합병증”이라며 “이번 데이터는 EGFR 혹은 HER2 Exon 20 삽입 돌연변이를 가진 중추신경계(CNS) 전이 환자에서 포지오티닙의 의미있는 임상적 치료 유용성을 보여준다”고 말했다.
또 다른 파트너사 제넨텍은 진행성 고형암환자를 대상으로 ‘벨바라페닙’과 코비메티닙 병용요법을 진행한 연구결과를 구연으로 발표했다.
벨바라페닙은 한미약품이 2015년 로슈 자회사 제넨텍에 라이선스 아웃한 항암 혁신신약 후보물질로, 이번 국내 연구에서 벨바라페닙의 신규 용량에서 내약성 및 안정성을 확인했다.
벨바라페닙은 강력한 선택적 RAF 이합체 억제제로, RAF와 RAS 변이로 인한 고형암에서 항종양 효과를 나타낸다. 이번 발표는 벨바라페닙의 HM-RAFI-103 연구로, 연세 암병원 종양내과(신촌세브란스) 신상준 교수가 진행했다.
이번 임상은 BRAF, NRAS 변이 고형암 환자에 ‘벨바라페닙’과 ‘코비메티닙’을 병용투여한 1b상 연구로, 용량증량(dose-escalation)과 적응증 확장(indication-specific), 두 단계로 나뉜 임상이다.
1차 평가변수로는 안전성과 내약성, 최대내약용량(MTD) 및 임상2상 권장용량(RP2D)을, 2차 평가변수로는 약동학과 약력학, 항종양효과를 확인하는 것으로 연구가 진행됐다.
적응증 확장 임상의 NRAS 변이 흑색종 연구에서는 13명의 환자 중 5명이 부분반응(PR)을 보였으며, 최고반응률(BORR)은 38.5%로 나타났다.
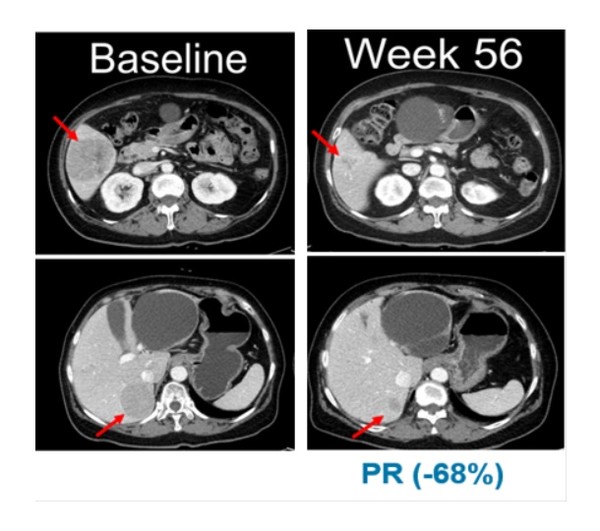
13명의 환자 중 11명은 이전에 면역관문억제제(CPI)를 투여받았으며, 면역관문억제제 투여 환자군 대상 최고반응률(BORR)은 45.5%로 확인됐다. 무진행생존기간(PFS)의 중간값은 7.3개월이다.
총 19명의 환자가 용량 증량 코호트에 등록됐고, 벨바라페닙 200mg 1일 2회(BID)와 코비메티닙40mg 1일 1회(QD) 용량을 투여한 3명 중 2명의 환자에서 각각 3단계의 대장염, 설사, 매스꺼움 증상이 나타났다.
하지만 벨바라페닙을 300mg 1일 2회(BID)까지 증량 투여하고 코비메티닙20mg 1일 1회(QD)로 감량했을 때, 용량제한독성(DLTs)은 나타나지 않았다.
발표를 진행한 신상준 교수는 “이번 연구를 통해 벨바라페닙의 우수한 안전성 및 항암효과를 확인했다”며 ”특히NRAS 유전자 돌연변이를 지닌 흑색종 환자에서 고무적인 효과를 확인할 수 있었다”고 설명했다.
한편 벨바라페닙의 전임상 및 임상 연구는 최근 세계 최고 권위 과학학술지인 네이처지 5월호에 게재된 바 있다. 국내 제약사가 개발한 신약 후보물질의 연구결과가 네이처지에 게재된 것은 이번이 최초다. 제넨텍은 현재 글로벌 NRAS 흑색종 임상을 추가 연구중이다.
아테넥스는 한미약품이 개발한 플랫폼 기술 ‘오라스커버리(ORASCOVERY)’를 적용해 도세탁셀 항암제를 경구용으로 전환환 오라독셀(도세탁셀+엔서퀴다) 약동학 연구 임상 1상을 발표했다.
이어 정맥주사용 항암제 파클리탁셀을 경구용으로 전환한 오락솔의 분자아형(Molecular subtype)에 따른 항암효과를 분석한 임상 3상 추가 하위분석 데이터 2건을 각각 포스터로 발표했다.
아테넥스는 정맥주사요법(IV) 대비 오라독셀의 생체 이용률(bioavailability), 안전성 및 내약성을 결정하기 위한 오픈라벨, 양방행 교차(Two-way crossover) 설계 약동학 연구 1상을 진행했다.
오라독셀 투여 시 용량 제한 독성 또는 약물 관련 심각한 부작용은 없었다. 또한, 평균 절대적 생체 이용률(Mean absolute bioavailability)은 15.9%였으며, 300mg/㎡용량에서 약동학(PK)이 비선형(non-linear)으로 나타났다.
이번 임상 결과와 관련된 연구를 바탕으로 아테넥스는 오라독셀 300mg/㎡용량 분할에 대해 추가적인 평가를 진행하고 있다.
또한 전이성 유방암(MBC) 환자 대상 분자아형에 따른 항암효과 임상 3상 사후분석 연구에 따르면, 총 402명의 무작위 배정 환자를 포함한 치료의향 모집단(ITT)에서의 오락솔의 객관적반응률(ORR)은 35.8%로 23.4%를 보인 파클리탁셀 정맥주사요법(IV) 보다 우월했다.
이외에도 HR양성/HER2음성 등 총 4개의 분자아형 그룹 모두에서 오락솔이 정맥주사요법(IV) 대비 객관적반응률(ORR)이 높았다.
한미약품 권세창 사장은 “한미약품과 긴밀한 연구협력을 맺고있는 파트너사들이 세계 최대 규모의 암학회에서 개발 중인 혁신신약의 유효한 결과를 발표하게 돼 기쁘다”며 “최근 네이처지에 벨바라페닙의 연구결과가 등재되는 등 글로벌 학계에서도 한미 개발 혁신신약을 주목하고 있다”고 밝혔다.


