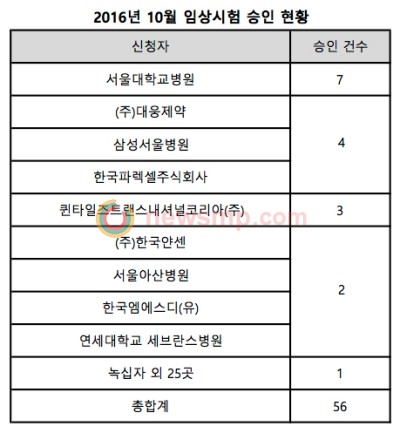
10월 한 달 동안 식품의약품안전처의 승인을 받은 임상시험이 총 56건으로 전월 50건 대비 12.0% 증가한 반면 전년 동월 62건 대비 9.7% 감소한 것으로 나타났다.
신청자별로 살펴보면 서울대학교병원이 7건으로 가장 많았으며, 대웅제약과 삼성서울병원, 한국파렉셀이 각 4건으로 뒤를 이었다.
퀸타일즈트랜스내셔널코리아는 3건의 임상시험을 승인 받았고, 한국얀센과 한국MSD, 서울아산병원, 연세대학교 세브란스병원이 각 2건씩 승인 받았고, 녹십자를 비롯한 총 26곳에서 각 1건씩 승인 받은 것으로 조사됐다.
국내 주요 제약사의 임상시험 현황을 살펴보면 대웅제약은 소화불량증치료제 ‘가스모틴’의 서방정인 DWJ1252의 임상3상 2건과 항궤양제 개량신약 DWJ1366의 임상1상 1건, 당뇨복합제 DWJ1381의 임상1상 1건이 확인됐다.
녹십자와 일양약품은 H7N9 인플루엔자 백신인 GC3113과 IYV7001의 임상1상을 각각 승인 받았고, 제일약품은 당뇨·고지혈증 복합제인 JLP-1310의 임상1상을 승인 받았다.
한독은 당뇨병치료제 테넬리아와 아마릴의 복합제에 대한 임상1상을, 한림제약은 다년성 알레르기성 비염 환자를 대상으로 한 HL151의 임상3상을, SK케미칼은 만 6~35개월을 대상으로 한 스카이셀플루 4가의 임상3상을, 종근당은 다발성골수종치료제 CKD-581의 임상1상을 각각 승인 받은 것으로 조사됐다.
한편 임상시험 단계별로는 연구자임상시험이 16건으로 가장 많았으며, 임상1상과 임상3상이 각 14건, 임상2상과 임상2b상이 각 5건, 임상1/2상과 임상3b상이 각 1건씩이었다.


