[의약뉴스] 지난 8윌, 임핀지(성분명 더발루맙, 아스트라제네카) 폐암 수술 전ㆍ후 보조요법의 미국FDA의 승인을 이끌어낸 AGEAN 3상 임상의 추가 분석 결과가 공개됐다. FDA 승인 결정에 힘을 더했다는 평가다.
9일(현지시간) 미국 샌디에이고에서 진행되고 있는 세계폐암학회 연례학술회의(WCLC 2024)에서 발표된 AGEAN 추가 분석에서는 임핀지 수술 전ㆍ후 보조요법을 받은 환자의 60% 이상이 3년간 재발 없이 생존한 것으로 보고됐다.
AEGEAN은 PD-L1 발현에 관계없이 절제 가능한 2A기~3B기 비소세포폐암 환자 802명을 대상으로 수술 전 선행화학요법에 임핀지 수술 전ㆍ후 보조요법을 추가(임핀지군), 수술 전 선행화학요법 단독요법군(위약군)과 비교하고 있다.
앞서 중앙추적관찰 11.7개월 시점에 평가한 이 연구의 중간 분석에서는 1차 평가변수인 무사건생존율(Event-Free Survival, EFS)과 병리학적완전관해율(pathological Complete Response, pCR)을 모두 의미있게 개선한 것으로 보고됐다.
12, 24개월 시점의 무사건생존율은 임핀지군이 73.4%와 63.3%로 위약군의 64.5%와 52.4%를 상회, 사건(질병 진행, 재발, 사망) 발생의 위험이 32% 더 적었다.(HR=0.68, 95% CI 0.53-0.88, p=0.004)
병리학적완전관해율은 임핀지군이 17.2%로 위약군의 4.3%를 크게 상회했다(그룹간 차이 13.0%, 95% CI 8.7-17.6, P<0.001).
이 같은 연구 결과를 근거로 미국FDA는 지난 8월, 임핀지를 EGFR 변이 또는 ALK 재배열이 없는 절제 가능한 초기(2A기~3B기) 비소세포폐암 성인 환자의 치료를 위한 수술 전ㆍ후 보조요법으로 승인했다.
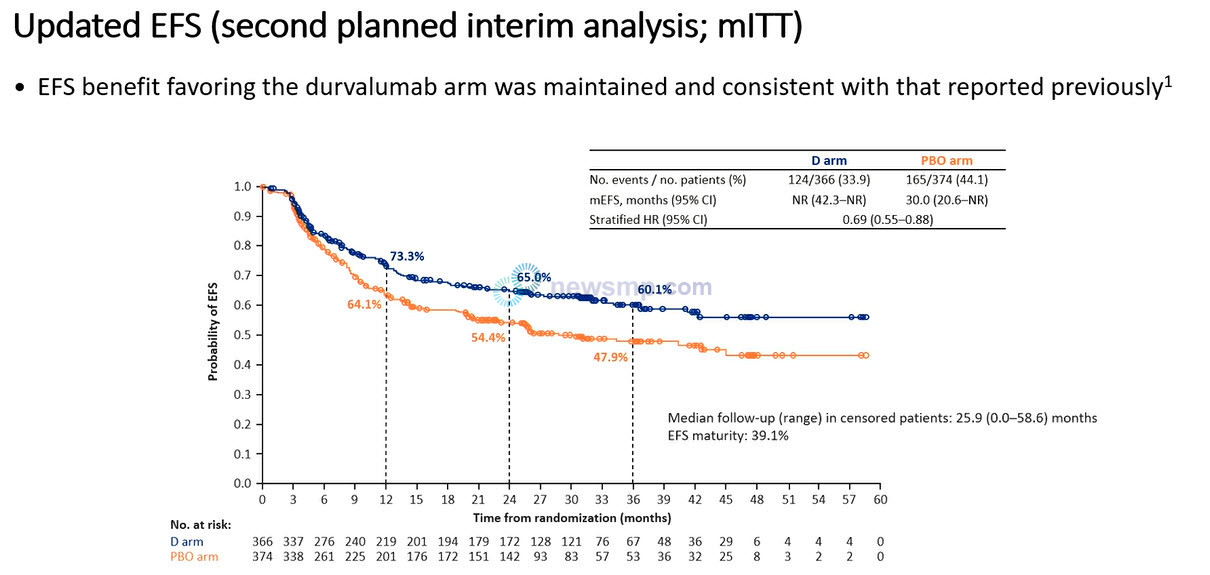
9일 발표된 추가 분석은 중앙추적관찰 25.9개월 시점의 자료로 임핀지 수술 전ㆍ후 보조요법의 이득이 유지됐다.
임핀지군의 무사건생존기간이 여전히 중앙값에 이르지 않은 가운데, 위약군은 30.0개월로 임핀지군의 사건 발생 또는 사망의 위험이 31% 더 낮은 것으로 집계됐다.(HR=0.69, 95% CI 0.55-0.88)
특히 임핀지군의 3년 무사건생존율은 60.1%로 여전히 60%를 상회한 반면, 위약군은 47.9%로 줄었다.
무사건생존에서의 이득은 연령이나 성별, 전신수행능력 평가점수(ECOG PS), 조직학적 분류(편평, 비편평), 병기, 림프절 전이, PD-L1발현율, 항암화학요법(시스플라틴/카보플라틴) 종류에 무관하게 일관된 양상을 보였으며, 특히 수술 후 보조요법까지 받은 환자에서 더 큰 이득을 보였다.
1, 2, 3년차 무질병생존율(Disease-Free Survival, DFS)은 임핀지군이 81.0%, 75.1%, 71.2%로 위약군의 74.1%, 62.4%, 61.4%를 크게 상회했으며, 두 그룹 모두 중앙값에 이르지 않았으나 임핀지군의 질병 발생 또는 사망의 위험이 34% 더 낮은 것으로 보고됐다.(HR=0.66, 95% CI 0.47-0.92, P=0.0137)
무질병생존에은 병리학적 완전관해를 달성하지 못한 환자(3년차 64.1% vs 60.8%, HR=0.82, 95% CI 0.58-1.15)보다 달성한 환자(3년차 91.6% vs 69.9%, HR=0.31, 95% CI 0.07-1.51)에서 더 큰 이득을 보였다.
중앙추적관찰 33.5개월 시점에 분석한 전체생존율(Overall Survival, OS) 데이터는 완성도가 35.3%에 그친 가운데, 임핀지군은 중앙값에 이르지 않았고, 위약군은 53.2개월로, 임핀지군이 보다 긍정적인 양상을 유지했다.(HR=0.89, 95% CI 0.70-1.14)
1, 2, 3년차 전체생존율은 임핀지군이 84.3%, 74.4%, 67.1%, 위약군은 85.3%, 72.2%, 63.9%로 조금씩 간극이 벌어지는 양상을 보였다.
탐색적 분석에서 폐암 특이 생존율은 1, 2, 3년차에 임핀지군이 각각 90.8%, 81.8%, 76.7%로 위약군의 89.0%, 76.2%, 68.9%를 상회했다.(HR=0.70, 95% CI 0.52-0.93)
안전성은 관리가 가능한 수준으로, 새롭게 보고된 이상반응 양상은 없었다.
이에 연구진은 이러한 연구 결과가 절제 가능한 비소세포폐암 환자의 새로운 치료옵션으로 이핀지 수술 전ㆍ후 보조요법을 승인한 FDA의 결정을 더욱 지지한다고 의미를 부여했다.


