[의약뉴스] 국산 신약 33호, 유한양행의 3세대 EGFR 표적치료제 렉라자(성분명 레이저티닙)가 드디어 미국의 허가 관문을 넘어섰다.
미국 식품의약국(Food and Drug Administration, FDA)은 19일(현지시간), 유한양행의 3세대 EGFR 표적치료제 렉라자(성분명 레이저티닙)와 얀센의 EGFR-MET 이중항체 리브리반트(성분명 아미반타맙) 병용요법을 EGFR 양성(Exon19del 또는 L858R) 비소세포폐암 1차 치료제로 승인했다고 발표했다.
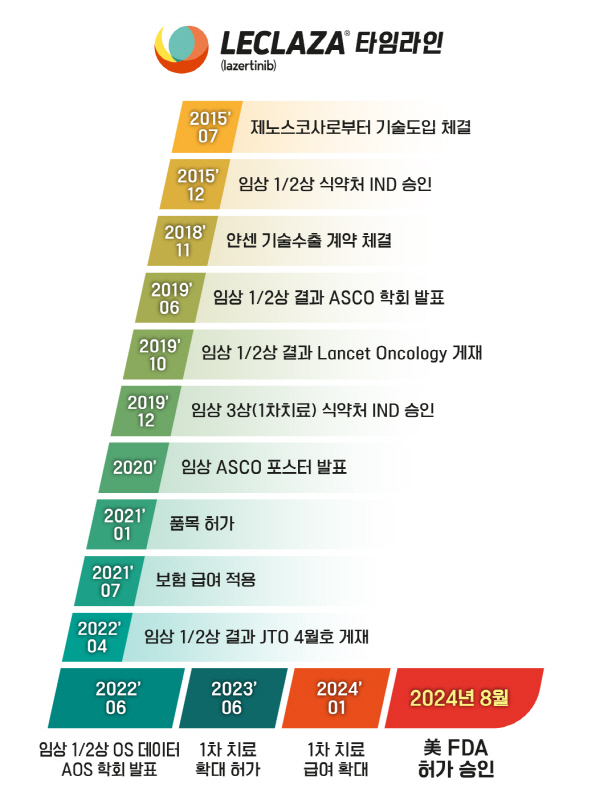
렉라자는 2015년, 유한양행이 제노스코사로부터 기술을 도입해 개발해 왔으며, 2018년에는 얀센에 기술을 수출, 리브리반트와의 병용요법으로 시너지를 평가해왔다.
이 가운데 지난해, 유럽임상종양학회(ESMO 2024)에서 이전에 전신 치료 이력이 없는 비소세포폐암 환자를 대상으로 렉라자와 리브리반트 병용요법을 타그리소(성분명 오시머티닙, 아스트라제네카)와 직접 비교, 우월성을 입증한 MARIPOSA 3상 임상 결과를 발표, 화제를 모았다.
이 연구에서 렉라자와 리브리반트 병용요법의 무진행생존기간(Progression-Free Survival, PFS) 중앙값은 23.7개월로, 타그리소 단독요법군의 16.6개월을 크게 상회, 질병 진행 또는 사망의 위험을 30% 줄인 것으로 보고했다(HR=0.70, 95% Ci 0.58-0.85, P=0.0002).
전체생존기간(Overall Survival, OS) 데이터는 아직 완성도가 부족한 상황이지만, 부정적인 추세는 관찰되지 않았다는 것이 미국FDA의 평가다.
다만, FDA는 렉라자와 리브리반트를 병용할 경우 정맥 혈전색전증과 관련한 심각한 이상반응이 보고됐다면서, 치료 시작 후 처음 4개월 동안은 예방적 항응고제를 투여해야 한다고 부연했다.


