[의약뉴스] 타그리소(성분명 오시머티닙, 아스트라제네카) 치료 실패한 환자에서 다시 타그리소를 활용, 항암화학요법을 피하는 연구들이 연이어 긍정적인 데이터를 제시해 귀추가 주목된다.
타그리소는 현재 전이성 EGFR 양성 비소세포폐암 치료에서 최선호 옵션으로 자리하고 있지만, 치료에 실패한 환자에서 후속 치료 옵션은 제한적이다.
이 가운데 26일(현지시간) 개막한 유럽폐암학회 연례학술회의(elcc 2025)에서는 타그리소 투약 중 질병이 진행한 전이성 EGFR 양성 비소세포폐암 환자에서 타그리소 병용요법을 평가하는 두 건의 임상 2상 결과가 연이어 공개됐다.
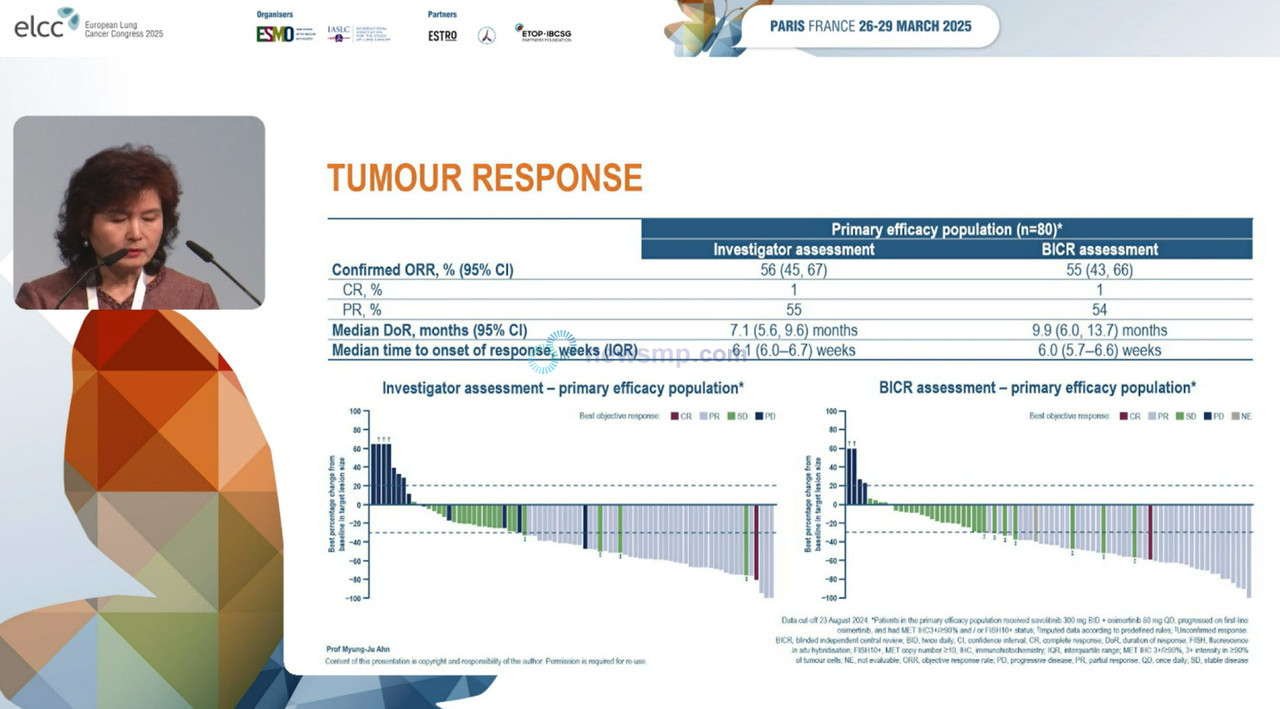
먼저 삼성서울병원 안명주 교수는 차수에 상관 없이 이전에 타그리소 치료 이력이 있는 환자 중 질병이 진행한 환자 가운데 MET 증폭 또는 융합이 확인된 환자에서 타그리소와 MET 억제제 사볼리티닙(아스트라제네카) 병용요법을 평가한 SAVANNAH 임상 2상의 일부 환자군에 대한 분석 결과를 공개했다.
SAVANNAH 임상에 참여 한 환자 중 사볼리티닙 1일 2회+타그리소 1일 1회 투약군에 배정된 환자들을 대상으로 1차 효능 평가군(타그리소 1차 치료 후 MET IHC 3+ 또는 FISH 10+인 환자)에 대한 효능 및 전체 환자군에 대한 안전성을 분석한 것.
사볼리티닙 1일 2회+타그리소 1일 1회군에 배정된 환자는 총 101명으로 이 가운데 1차 효능 평가군은 80명이었으며, 연령 중앙값은 66세로 70%가 여성이었고, 백인이 71%, 전신수행능력 평가점수(ECOG PS)가 1인 환자가 60%, 뇌전이 환자는 39%를 차지했다.
분석 결과 연구자가 평가한 객관적 반응률(Objective Response Rate, ORR)은 56%(95% CI 45-67)로 50%를 상회했으며, 독립적 검토위원회(BICR)가 평가한 객관적 반응률도 55%(95% CI 43-66)로 유사했다.
반응 지속기간(Duration of Reposne, DoR)은 각각 7.1개월과 9.9개월, 무진행생존기간(Progression-Free Survival, PFS) 중앙값은 7.4개월과 7.5개월로로 유사했다.
안전성에 있어서는 57%의 환자에서 3등급 이상의 이상반응이 보고됐으며, 치료와 관련한 3등급 이상의 이상반응은 32%로 집계됐다.
심각한 이상반응은 31%로, 이상반응으로 사볼리티닙을 중단한 환자는 16%, 타그리소를 중단한 환자는 12%로 보고됐다.
가장 흔하게 보고된 이상반응은 말초부종(58%), 메스꺼움(45%), 설사(33%), 구토(21%) 등으로 새로운 안전성 문제는 보고되지 않았다.
결론적으로 사볼리티닙과 타그리소 병용요법의 내약성은 우수했으며, 1차 타그리소 치료 중 질병이 진행한 MET IHC 3+ 또는 FISH 10+ 환자에서 임상적으로 의미있고 지속적인 반응을 보였다는 평가다.
현재 사볼리티닙과 타그리소 병용요법은 이러한 환자들을 대상으로 SAFFRON 3상 임상을 진행 중이다.

타그리소 1차 치료 중 질병이 진행한 환자에서 다양한 조합을 평가하고 있는 ORCHARD 플랫폼 임상 2상 연구 중 아스트라제네카와 다이이찌산쿄가 공동개발하고 있는 항체약물접합체(Antibody–Drug Conjugate, ADC) 다트로웨이(성분명 다토포타맙데룩스테칸)와 타그리소 병용요법을 평가하고 있는 모듈 10 연구에서도 긍정적인 데이터가 도출됐다.
이 연구는 다트로웨이 용량 증량 연구로, 타그리소 1차 치료 중 질병이 진행한 환자를 대상으로 타그리소에 더해 다트로웨이 3주 1회 kg 당 4mg 또는 6mg을 추가한 2개 코호트를 평가했다.
연구에는 4mg군 35명, 6mg군 34명 등 총 69명의 환자가 참여했으며, 치료 지속기간은 두 코호트가 각각 9.0개월과 9.8개월, 중앙 추적관찰 기간은 13.4개월과 13.8개월이었다.
분석 결과 두 코호트의 객관적반응률은 43%와 36%로 유사했으며, 9개월 반응지속률은 15%와 64%, 무진행생존기간 중앙값은 9.5개월과 11.7개월로 6mg 코호트가 조금 더 긍정적인 데이터를 제시했다.
반면, 3당급 이상의 치료와 관련한 이상반응은 6mg 코호트가 56%로 4mg 코호트의 34%를 상회했다.
이상반응으로 인한 다트로웨이 용량 감량은 각각 23%와 59%에서 보고됐으며, 간질성폐질환 및 폐렴은 각각 3%와 6%로 집계됐다.
타그리소 1차 치료 중 질병이 진행한 EGFR 양성 전이성 비소세포폐암 환자에서 다트로웨이와 타그리소 병용요법이 관리 가능한 안전성에 유망한 효능을 보였으며, 전반적인 위해-유익비율(benefit/risk profile)을 고려할 때 다트로웨이 6mg/kg이 더 선호하는 시작 용량이어야 한다는 것이 연구진의 평가다.


