[의약뉴스 in 시카고] 다이이찌산쿄의 항체약물접합체(Antibody Drug Conjugate, ADC) 엔허투(성분명 트라스투주맙데룩스테칸)이 HER2 양성 전이성 대장암에서도 가능성을 확인했다.
4일(현지시간) 미국임상종양학회 연례학술회의(ASCO 2023)에서는 면역화학조직검사(immunohistochemistry)상 3+ 또는 2+/형광제자리부합법(in situ hybridization) 양성인 HER2 양성 전이성 대장암 환자에서 엔허투의 안전성과 효능을 평가한, DESTINY-CRC02 임상 2상 결과가 공개됐다.
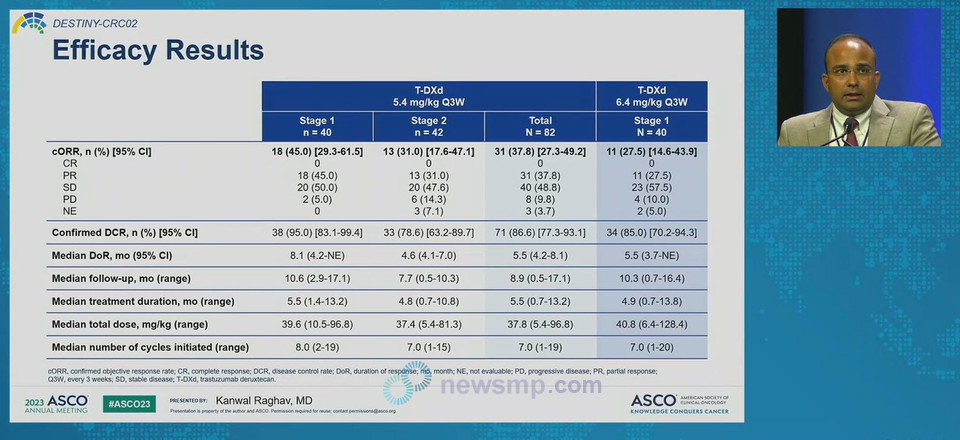
이 연구는 이전에 표준요법을 받은 환자들을 대상으로 했으며, 평균 3~4차례 치료 이력이 있었다. 또한 RAS 야생형이 80% 이상을 차지했다.
환자들은 처음에 80명을 모집 각각 5.4mg/kg에 40명, 6.4mg/kg에 40명을 배정했으며, 이후 5.4mg/kg군에 42명을 추가 배정했따.
중앙 추적관찰기간은 5.4mg/kg이 8.9개월, 6.4mg/kg은 10.3개월이었으며, 분석 결과 반응 지속기간(Duration of Response, DoR) 중앙값은 두그룹 모두 5.5개월, 무진행생존기간(Progression-Free Survival, PFS) 중앙값은 5.4mg/kg이 5.8개월, 6.4mg/kg은 5.5개월로 집계됐다.
최적 전체 반응률(Best Overall Survival, BOS)는 이전에 HER2 항체 치료 이력이 있는 환자에서 5.4mg/kg 군이 41.2%, 6.4mg/kg은 40.0%로 집계됐다.
또한 IHC 3+ 환자에서는 46.9%와 29.4%로 집계됐으며, 2+/ISH+ 환자에서는 5.4mg/kg 군에서는 18명 중 1명(5.6%), 6.4mg/kg군에서는 6명 중에 1명(16.7%)만 반응이 확인됐다.
RAS 야생형인 환자에서는 각각 39.7%와 32.4%로 집계됐고, RAS 변이 환자에서는 5.4mg/kg군이 28.6%(14명 중 4명)으로 집계됐으나, 6.4mg/kg 군에서는 6명 모두 반응이 나타나지 않았다.
이와 관련, 연구진은 엔허투가 HER2 양성 전이성 대장암 환장에서 5.4mg/kg과 6.4mg/kg 모두 유망한 항 종양 활성을 보였다고 평가하면서, 특히 5.4mg/kg은 HER2 항체 치료 이력이나 RAS 변이 상태에 무고나하게 항 종양 활성을 보였고, 안전성은 이전에 알려진 이상반응 양상이 유지됐다고 분석했다.


