[의약뉴스] GSK 항PD-1 면역관문억제제 젬퍼리(성분명 도스탈리맙)이 자궁내막암에서 승전보를 이어가고 있다.
자궁내막암은 부인과암 중에서도 흔한 암종이며, 전세계적으로 사망률이 해마다 증가하고 있다.
조기에 발견되면 예후가 상당히 좋은 것으로 알려져 있으나, 말기암 환자의 5년 생존율은 17%에 불과하다.
절제가 어려운 진행성 자궁내막암 1차 치료에는 전통적으로 카보플라틴과 파클리탁셀 병용요법 또는 호르몬요법을 시행했으나, 치료효과는 미미했다.
이에 최근에는 다양한 면역항암제들이 자궁내막암에서 가능성을 타진하고 있으며, 이 가운데 일부 면역항암제들이 불일치 복구 결함(dMMR)/고빈도-현미부수체 불안정성(MSI-H) 등 특정 환자에서 긍정적인 결과를 도출하며 희망을 제시하고 있다.
젬퍼리 역시 자궁내막암에서 고무적인 결과를 도출하고 있다.
특히 지난 2월에는 고형종양 환자를 대상으로 젬퍼리 단독요법을 평가한 GARENT 임상 중 이전에 백금 함유 요법 후 진행된 dMMR 진행성 또는 재발성 자궁내막암 환자 코호트에서 확인된 긍정적인 결과를 토대로, 미국 식품의약국(FDA)의 최종 승인을 획득했다.
이에 앞서서는 지난 12월, 원발성 진행성 또는 재발성 자궁내막암 환자를 대상으로 한 임상 3상 RUBY(ENGOT-EN6/GOG3031/NSGO)에서도 긍정적인 결과를 도출했다는 탑라인 리포트가 발표되기도 했다.
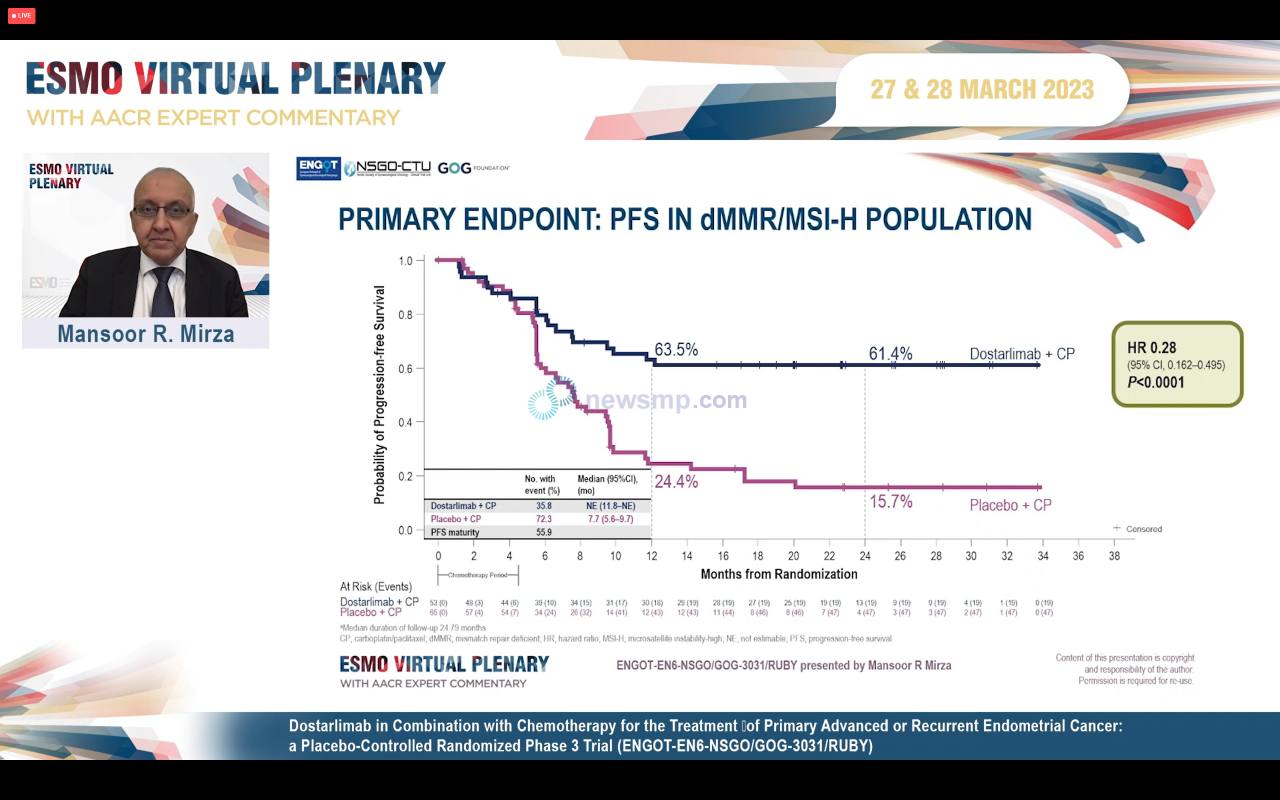
이어 27일, 유럽종양학회 가상 플레너리 세션(ESMO Virtual Plenary)에서는 RUBY 3상 임상의 구체적인 결과가 공개됐다.
이 연구는 원발성 재발/진행성 자궁내막암 환자를 대상으로 현재의 표준요법인 카보플라틴+파클리탁셀 병용요법에 젬퍼리 또는 위약을 추가해 안전성과 유효성을 평가하고 있다.
모집단은 3/4기 또는 처음 재발한 자궁내막암 환자로, 방사선치료나 수술 단독 또는 병용치료에도 완치의 가능성이 낮은 환자들을 대상으로 했다.
또한, 전신수행능력(ECOG PS) 0 또는 1로, 장기 기능이 적절하며, 이전 전신 치료 이력이 없거나, 재발 또는 치료 완료 후 6개월 이상 질병이 진행된(Progressive Disease, PD) 환자들이 연구에 참여할 수 있었다.
연구에 참여한 환자들은 1대 1 무작위 배정돼 3주 간격 6주기에 걸쳐 카보플라틴(5mg/ml/min)+파클리탁셀(175mg/m2) 병용요법을 투약하면서 젬퍼리(500mg 정맥주사) 또는 위약을 추가로 투약했으며, 6주기가 마무리되면 3년까지 6주 간격 젬퍼리(1000mg 정맥주사) 또는 위약 단독요법을 이어갔다.
연구의 1차 평가변수는 연구자가 평가한 무진행생존율(Progression-Free Survival, PFS)과 전체생존율(Overall Survival, OS)로 정의했다.
또한 2차 평가변수는 독립적 검토위원회가 평가한 무진행생존율과 2차 무진행생존율(PFS2), 객관적반응률(Objective Response Rate, ORR), 반응지속기간(Duration Of Response, DOR), 질병조절률(Disease Control Rate, DCR), 건강 관련 삶의질 및 환자 보고 결과(HRQOL/PRO), 안전성 등으로 정의했다.
1차 평가변수에 대한 분석은 먼저 dMMR/MSI-H 환자에서 무진행생존율의 유효성이 확인되면 전체 환자(ITT)에서 무진행생존율을 평가하고, 여기에서 다시 유효성이 확인되면, 전체 환자에서 전체생존율을 평가하도록 했다.
이후 사전 지정된 하위 분석으로 불일치 복구 정상(MMRp)/현미부수체 안정(MSS) 환자에서 무진행생존율, dMMR/MSI-H 환자에서 전체생존율, MMRp/MSS 환자에서 전체생존율 등을 평가하도록 했다.
연구에는 젬퍼리 병용요법군에 총 245명, 위약군에 총 249명이 배정됐으며, 이 가운데 dMMR/MSI-H 환자는 젬퍼리 군에 53명, 위약군은 65명이 포함됐다.
전체 환자 중 약 20%는 이전에 항암화학요법 치료 이력이 있었다. 카보플라틴+파클리탁셀 치료 이력이 있었던 환자가 약 15%를 차지했다.
27일 공개된 자료는 1차 분석 결과로, 먼저 1차 평가변수 중 dMMR/MSI-H 환자에서 12개월 및 24개월차 무진행 생존율은 젬퍼리군이 63.%와 61.4%, 위약군은 24.4%와 15.7%로 상당한 차이를 보였다.
1차 분석을 위한 중앙 추적관찰 24.79개월 시점까지 젬퍼리 투약군의 무진행생존기간은 중앙값에 이르지 않았으나, 위약군은 7.7개월에 그쳐, 젬퍼리의 질병 진행 또는 사망의 위험이 72% 낮았으며(HR=0.28, 95% CI 0.162-0.495, P<0.0001), 통계적으로 의미있는 차이를 나타냈다.
전체 환자군에서도 젬퍼리군의 12, 24개월차 무진행생존율이 48.2%와 36.1%, 위약군은 29.0%와 18.1%로 여전히 젬퍼리군의 무진행생존율이 더 높았으나, 차이는 dMMR/MSI-H 환자보다 줄어들었다.
중앙 추적관찰 25.38개월 시점에 평가한 무진행생존기간 중앙값은 젬퍼리군이 11.8개월, 위약군은 7.9개월로 젬퍼리군의 질병 진행 또는 사망의 위험이 36% 더 낮았으며(HR=0.64, 95% CI 0.507-0.800, P<0.001), 역시 통계적으로도 의미있는 차이를 나타냈다.
전체 환자들을 대상으로 평가한 12, 24개월차 전체생존율 또한 젬퍼리군이 84.6%와 71.3%로 위약군의 71.3%와 56.0%를 상회했다.
특히 위약군에서는 후속 치료로 면역항암제를 투약한 환자가 34.5%로 젬퍼리군의 15.5%를 두 배 이상 상회했음에도 수치상으로 적지 않은 차이를 보였다.
그러나 전체생존기간은 두 그룹 모두 중앙 추적관찰 25.38개월 시점까지 중앙값에 이르지 않았으며(데이터 숙성도 33%), 젬퍼리 투약군의 사망 위험이 36% 더 낮은 경향을 보였으나(HR=0.64, 95% CI 0.464-0.870, P=0.0021), 사전에 지정한 1차 분석에서의 유효성 범주(P<0.00177)에는 들어서지 못했다.
dMMR/MSI-H 환자에서 12, 24개월 전체생존율인 젬퍼리군이 90.1%와 83.3%로 위약군의 79.6% 및 58.7%를 크게 상회했으며, 젬퍼리군의 사망 위험이 70% 더 낮은 경향을 보였다.(HR=0.30, 95% CI 0.127-0.698)
MMRp/MSS 환자군에서 12, 24개월차 무진행생존율은 젬퍼리군이 43.5%와 28.4%, 위약군이 30.6%와 18.8%로 역시 수치상으로는 젬퍼리군이 더 높았다.(HR=0.76, 95% CI 0.592-0.981)
MMRp/MSS 환자의 12, 24개월차 전체생존율 또한 젬퍼리군이 83.1%와 67.7%로 위약군의 81.8%와 55.1%보다 수치상으로 더 높았다.(HR=073, 95% CI 0.515-1.024)
dMMR/MSI-H 환자에서 객관적 반응률은 젬퍼리군이 77.6%로 위약군의 69.0%를 상회했으며, 이 가운데 완전반응(Complete Response, CR)은 젬퍼리군이 30.6%, 위약군은 20.7%로 집계됐다.
반응지속기간은 위약군이 5.4개월에 그친 반면, 젬퍼리군은 중앙값에 이르지 않았다.
MMRp/MSS 환자에서 객관적반응률은 젬퍼리군이 68.1%, 위약군이 63.4%로 역시 젬퍼리군이더 높았으나 차이는 크게 줄어들었다.
완전반응이 나타난 환자 또한 젬퍼리군이 23.3%, 위약군은 19.3%로 젬퍼리군이 조금 많았다. 반응 지속기간 중앙값은 젬퍼리군이 8.6개월로 위약군의 6.3개월을 상회했다.
안전성에 있어서는 젬퍼리군이 위약군보다 이상반응이 조금 더 빈번하게 나타났다.
3둥급 이상의 치료관련 이상반응은 젬퍼리군이 70.5% 위약군은 59.8%로 집계됐으며, 치료와 관련한 심각한 이상반응은 젬퍼리군이 37.8%, 위약군은 27.6%로 보고됐다.
젬퍼리 또는 위약 관련 이상반응으로 치료를 중단한 환자는 젬퍼리군이 17.4%로 위약군의 9.3% 보다 두 배 가까이 많았다.
뿐만 아니라 위약군에서는 보고되지 않은 치료와 관련한 사망이 젬퍼리 투약군에서는 5명이 나타났으며, 이 가운데 2명은 젬퍼리의 이상반응과 연관이 있었던 것으로 보고됐다.
그럼에도 불구하고 전반적으로 안전성은 관리 가능한 수준이었으며, 각 약제가 가진 약제의 이상반응 양상이 유지됐다는 설명이다.
나아가 환자가 보고한 삶의 질 평가에서는 전체 환자나 dMMR/MSI-H 환자 모두 위약군은 기저시점보다 악화된 양상을 보였던 반면, 젬퍼리군은 시간이 갈수록 더 개선되는 양상을 보였다.
이와 관련, 연구진은 젬퍼리와 카보플라틴+파클리탁셀 병용요법이 무진행생존율을 임상적으로, 또 통계적으로 의미있게 개선했으며, 전체생존율도 개선되는 양상을 보였다면서, 이 3제 조합이 원발성 재발/전이성 자궁내막암의 새로운 표준요법이라는 것을 보여준다고 의미를 부여했다.


