mFOLFOX6 이어 CAPOX 조합에서도 긍정적 결과 도출
[의약뉴스] 아스텔라스가 개발하고 있는 세계 최초의 클라우딘18.2(CLDN18.2) 표적 단일클론 항체, 졸베툭시맙이 치료제가 마땅치 않은 HER2 음성 위ㆍ위식도 접합부 선암에서 두 번째 승전보를 전했다.
아스텔라스는 지난해 이미 CLDN18.2 양성/HER2 음성 위ㆍ위식도 접합부 선암 환자를 대상으로 진행한 두 건의 3상 임상, SPOTLIGHT와 GLOW에서 모두 긍정적인 결과를 도출했다는 탑 라인 리포트를 한 달 간격으로 연이어 공개한 바 있다.
SPOTLIGHT는 졸베툭시맙과 mFOLFOX6(옥살리플라틴, 류코보린, 플루오로우라실 포함 항암화학요법) 병용요법의, GLOW은 졸베툭시맙과 CAPOX(카페시타빈, 옥살리플라틴) 병용요법의 효능과 안전성을 평가했다.
이 가운데 지난 1월에는 미국임상종양학회 소화기암 심포지엄(ASCO GI 2023)을 통해 SPOLIGHT 임상의 구체적인 결과를 먼저 공개했으며, 이어 3월 23일 오전(한국시간)에는 미국임상종양학회 월례 플레너리 세션(Monthly plenary)을 통해 GLOW 임상 구체적인 결과를 공개했다.
지난 1월 공개된 SPOLITGHT 3상은 이전 치료 경험이 없고 절제 불가능 혹은 국소 진행된 CLDN18.2 양성/HER2 음성 위ㆍ위식도 접합부 선암 환자 565명을 대상으로 졸베툭시맙과 mFOLFOX6 병용요법을 mFOLFOX6 단독(+위약)요법과 비교했다.
그 결과 1차 평가변수인 무진행생존기간(Progression-Free Survival, PFS) 중앙값은 졸베툭시맙+mFOLFOX6군이 10.61개월, 위약+mFOLFOX6군이 8.67개월로, 졸베툭시맙 투약군의 질병 진행 또는 사망의 위험이 25% 더 낮았다(HR=0.751, 95% CI 0.598-0.942, P=0.0066)
12, 24개월 시점의 무진행생존율은 졸베툭시맙 그룹이 49%와 24%, 위약군은 35%와 15%로 집계됐다.
전체생존기간(Overall Survival, OS) 중앙값 역시 졸베툭시맙 투약군이 18.23개월. 위약군은 15.54개월로 졸베툭시맙 투약군의 사망 위험이 25% 더 낮았다.(HR=0.750, 95% CI 0.601-0.936, P=0.0053)
12, 24,36개월 시점의 전체생존율은 졸베툭시맙 그룹이 68%, 39%, 21%, 위약군은 60%, 28%, 9%로 집계됐다.
다만, 객관적반응률(Objective Response Rate, ORR)은 두 그룹이 60.7%와 63.2%로 비슷했고, 반응지속기간(Duration of Response, DoR) 역시 8.51개월과 8.11개월로 차이가 크지는 않았다.
인전성에 있어서는 졸베툭시맙 투약군에서 치료와 관련해 가장 흔하게 보고된 이상반응은 메스꺼움(졸베툭시맙 82.4%, 위약 60.8%), 구토(67.4%, 35.6%), 식욕 감소(47.0%, 33.5%) 등이 보고됐으며, 치료와 관련한 심각한 이상반응의 발생률은 두 그룹이 유사했다.(44.8%, 43.5%)

23일 공개된 GLOW 3상 결과 역시 SPOLIGHT와 크게 다르지 않았다.
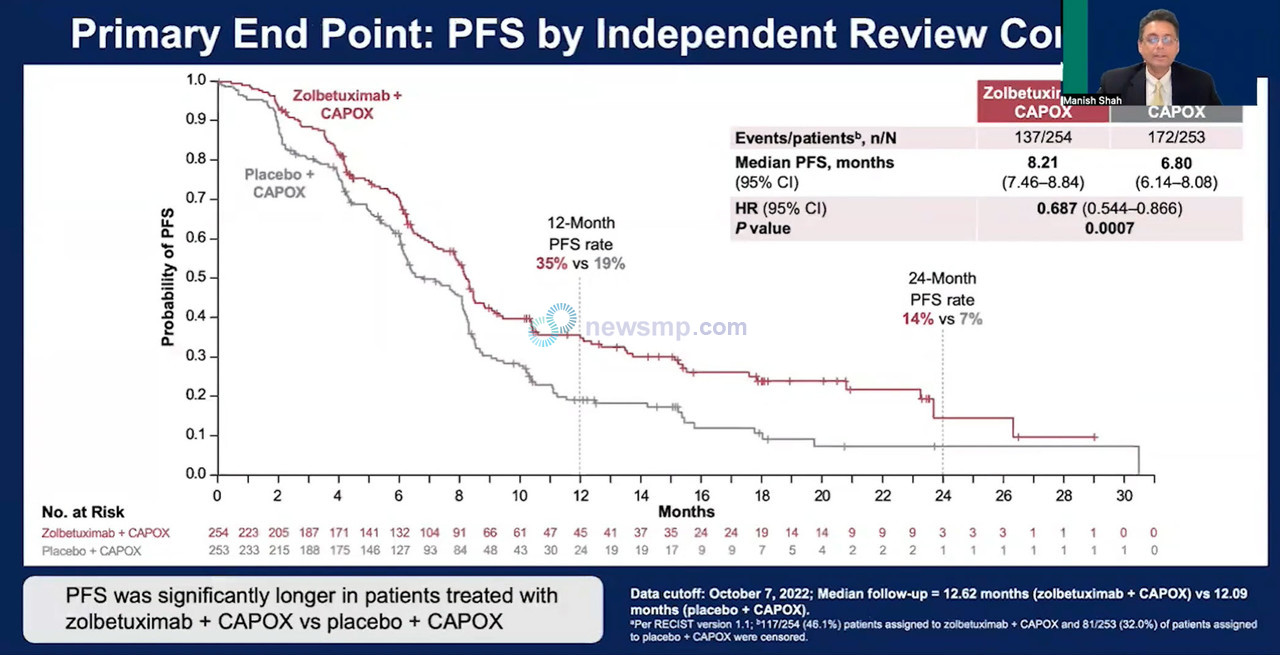
이 연구 역시 SPOLIGHT와 마찬가지로 이전 치료 경험이 없고 절제 불가능 혹은 국소 진행된 CLDN18.2 양성/HER2 음성 위ㆍ위식도 접합부 선암 환자 507명을 각각 졸베툭시맙+CAPOX군에 254명, 위약+CAPOX군에 253명을 배정, 안전성과 유효성을 평가했다.
분석은 졸베툭시맙+CAPOX군의 중앙 추적관찰 기간이 12.62개월, 위약+CAPOX군은 12.09개월 시점에 진행됐다.
분석 결과 1차 평가변수인 무진행생존기간 중앙값은 졸베툭시맙+CAPOX군이 8.21개월, 위약+CAPOX군은 6.80개월로 졸베툭시맙+CAPOX군의 질병 진행 또는 사망의 위험이 31% 더 낮았으며(HR=0.687, 95% CI 0.544-0.866, P=0.0007), 통계적으로도 의미있는 차이를 보였다.
무진행생존율은 처음부터 벌어져 12개월 및 24개월에는 졸베툭시맙+CAPOX군이 35%와 14%, 위약+CAPOX군은 19%와 7%로 약 두 배의 차이를 보였다.
무진행생존에 있어 졸베툭시맙+CAPOX군의 이득은 나이나 성별, 지역, 전이 병변 수, 위절제수술 이력, Lauren 분류 등 사전에 지정한 대부분의 하위그룹에서 일관된 경향을 보였으나, 원발위치가 위식도 접합부인 경우에는 모집단 규모가 작아 상반된 경향을 보였다.
2차 평가변수였던 전체생존율 역시 졸베툭시맙+CAPOX군이 14.39개월, 위약+CAPOX군은 12.16개월로 졸베툭시맙+CAPOX군의 사망 위험이 약 23% 더 낮았으며(HR=0.771, 95% CI 0.615-0.965, P=0.0118) 통계적으로 의미있는 차이를 나타냈다.
전체생존율 또한 처음부터 벌어졌으며, 12, 24개월 시점에는 졸베툭시맙+CAPOX군이 58%와 29% 위약군은 51%와 17%로 간극이 늘었다.
전체생존에 있어 졸베툭시맙+CAPOX군의 이득 또한 사전에 지정한 대부분의 하위그룹에서 일관된 경향을 보였으나, 원발위치가 위식도 접합부인 경우에는 차이가 없었다.
또한, SPOLIGHT 연구와 마찬가지로 GLOW에서도 졸베툭시맙+CAPOX군과 위약+CAPOX군간 반응률에 차이가 나타나지 않았다.
객관적반응률은 졸베툭시맙+CAPOX군이 53.8%, 위약+CAPOX군이 48.8%, 반응지속기간 중앙값은 각각 6.28개월과 6.18개월로 큰 차이가 없었다.
다만, 객관적 반응이 나타난 환자 중 완전반응(Complete Response, CR)은 졸베툭시맙+CAPOX군이 6명(3.1%)로 위약+CAPOX(3명, 1.5%)보다 조금 더 많았다.
SPOLIGHT와 마찬가지로 이상반응 발현율에 있어서는 두 그룹간에 차이가 거의 없었으며, 졸베툭시맙+CAPOX 그룹에서 메스꺼움과 구토가 흔하게 보고됐지만, 대부분 1~2회 투약기간 중에 발생했으며, 2회 투약 이후로는 10% 미만으로 줄어들었다.
이와 관련, 연구진은 졸베툭시맙+CAPOX가 임상적으로, 또 통계적으로 생존율을 의미있게 개선했으며, 내약성은 우수하고 이상반응은 관리가 가능한 수준이었다고 평가했다.
이어 SPOLIGHT에서 관찰된 안전성과 유효성이 일관적으로 유지됐다면서 졸베툭시맙이 CLDN18.2를 표적해 전이성 위ㆍ위식도 접합부 선암 치료에 의료적 미충족 수요(unmet medical needs)를 성공적으로 해결했다고 의미를 부여했다.
나아가 GLOW 임상 결과는 절제 불가능하거나 전이성 CLDN18.2 양성/HER2 음성 위ㆍ위식도 접합부 선암 환자의 새로운 표준요법으로 승인한다고 평가했다.
한편, 이 연구에서 CLDN18.2 검사 결과 양성이었던 환자들 중 약 22%가 PD-L1 발현율(CPS) 5% 이상이었던 것으로 확인됐다.
다시 말해 연구에 참여한 환자 4~5명 중 한 명은 면역항암요법에 잘 반응할 것으로 예상할 수 있는 환자들이었다는 의미다.
앞서 Checkmate649 임상에서 면역항암제 옵디보(성분명 니볼루맙, BMSㆍ오노)와 항암화학 병용요법은 항암화학 단독과 비교해 전체생존율 및 무진행생존율을 개선했다.
대조군 대비 전체생존기간 중앙값 개선 폭(절대값 기준)은 전체 환자군에서 2.1개월(HR=0.79), PD-L1 발현율 5% 이상인 환자에서는 3.3개월(HR=0.70)로 졸베툭시맙이 SPOLIGHT 임상에서 보여준 2.7개월(HR=0.75)과 GLOW에서 나타난 2.2개월(HR=0.77)과 크게 다르지 않았다.
또한 대조군 대비 24개월 전체생존율 차이(절대값 기준) 역시 Checkmate649에서 12%, SPOLIGHT에서 11%, GLOW에서 12%로 유사했다.
Checkmate649에서 대조군 대비 무진행생존기간 중앙값 개선폭(절대값 기준)은 전체 환자군에서 0.8개월(HR=0.79)에 그쳤으나, PD-L1 발현율 5% 이상인 환자군은 2.2개월(HR=0.70)로 집계됐으며, SPOLIGHT는 1.9개월(HR=0.75), GLOW는 1.4개월(HR=0.68)로 집계돼 절대값에서는 차이를 보였지만, 상대위험비는 유사했다.
다만, Checkmate649에서는 고빈도-현미부수체 불안정성(microsatellite instability high, MSI-H) 환자에서 전체생존기간 개선폭(절대값 기준)이 26.4개월(HR=0.34)에 달했고, SPOLIGHT나 GLOW에서 졸베툭시맙이 차이를 보여주지 못했던 객관적반응률에서도 옵디보는 전체환자군에서 12%, PD-L1 발현율 5% 이상에서는 15%의 차이를 보였다.


