프랑스 연구진, 환자 특성에 따른 치료 전략 필요성 제기
[의약뉴스] 진행성/전이성 신장암(신세포암)의 표준 요법으로 자리하고 있는 옵디보(성분명 니볼루맙, BMSㆍ오노)와 카보메틱스(성분명 카보잔티닙, 입센)가 입지를 더욱 굳건하게 다졌다.
2023년 미국임상종양학회 비뇨생식기암 심포지엄(ASCO GU 2023) 최종일인 19일(한국시간), 주요 세션들은 옵디보와 카보메틱스 관련 임상연구들로 가득 찼다.
CheckMate 9ER 추가 분석에서는 3년까지 옵디보와 카보메틱스 병용요법의 이득이 유지된 것으로 나타났고, HCRN GU16-260 추가 분석에서는 옵디보 기반 요법이 추가 치료 없이 생존하는 기간 대부분을 3등급 이상의 이상반응 없이 지낼 수 있었던 것으로 보고됐다.
◇CheckMate 9ER, 3년까지 치료 이득 유지
진행성 신세포암 1차 치료에서 옵디보와 카보메틱스 병용요법을 수텐(성분명 수니티닙, 화이자)과 비교하고 있는 CheckMate 9ER은 3년차 분석 결과가 공개됐다.
총 651명의 환자를 대상으로 진행된 이 연구는 옵디보 2주 1회 240mg + 카보메틱스 1일 1회 40mg 투약 그룹과 수텐 1일 1회 50mg 6주 1주기 투약(4주 투약 후 2주 휴약) 그룹을 1대 1로 배정해 질병이 진행되거나 독성을 견딜 수 없을 때까지 최대 2년간 진행됐다.
1차 평가변수는 독립적 검토 위원회(Blinded Independent Central Review, BICR)가 평가한 무진행생존율이었고, 2차 평가변수는 전체생존율과 객관적반응률(Objective Response Rate, ORR), 안전성이었다.
특히 이 연구는 진행성 신세포암 관련 병용요법 연구 가운데 IMDC(International Metastatic RCC Database Consortium, 국제 전이성 신세포암 데이터베이스 컨소시엄) 기준 고위험군의 환자들이 가장 많이 포함됐다는 측면에서 주목을 받았다.
그럼에도 불구하고 1차 분석(중앙 추적관차 18.1개월 시점)에서 1차 평가변수인 무진행 생존기간 중앙값이 16.6개월로 대조군의 8.3개월과 비교해 두 배 더 길었고, 질병 진행 또는 사망의 위험은 49%(HR=0.51, p<0.0001)를 낮춘 것으로 보고됐다.
당시 전체 생존기간은 중앙값에 도달하지 않았지만, 옵디보+카보메틱스군의 사망 위험이 40% 더 낮았으며(HR=0.60, p=0.0010), 이 같은 결과는 사전에 정의된 IMDC 위험군이나 PD-L1 발현율 등과 무관하게 일관된 경향을 보였다.
객관적 반응률 역시 옵디보+카보메틱스 그룹이 55.7%, 수텐군은 27.1%로 두 배 이상 높았고, 이 가운데 완전 반응(Complete Response, CR)도 8.0%와 4.6%로, 상당한 차이를 보였다.
반응지속기간 중앙값(median Duration Of Response, mDOR)은 옵디보+카보메틱스군이 20.2개월, 수텐군은 11.5개월로 집계됐다.
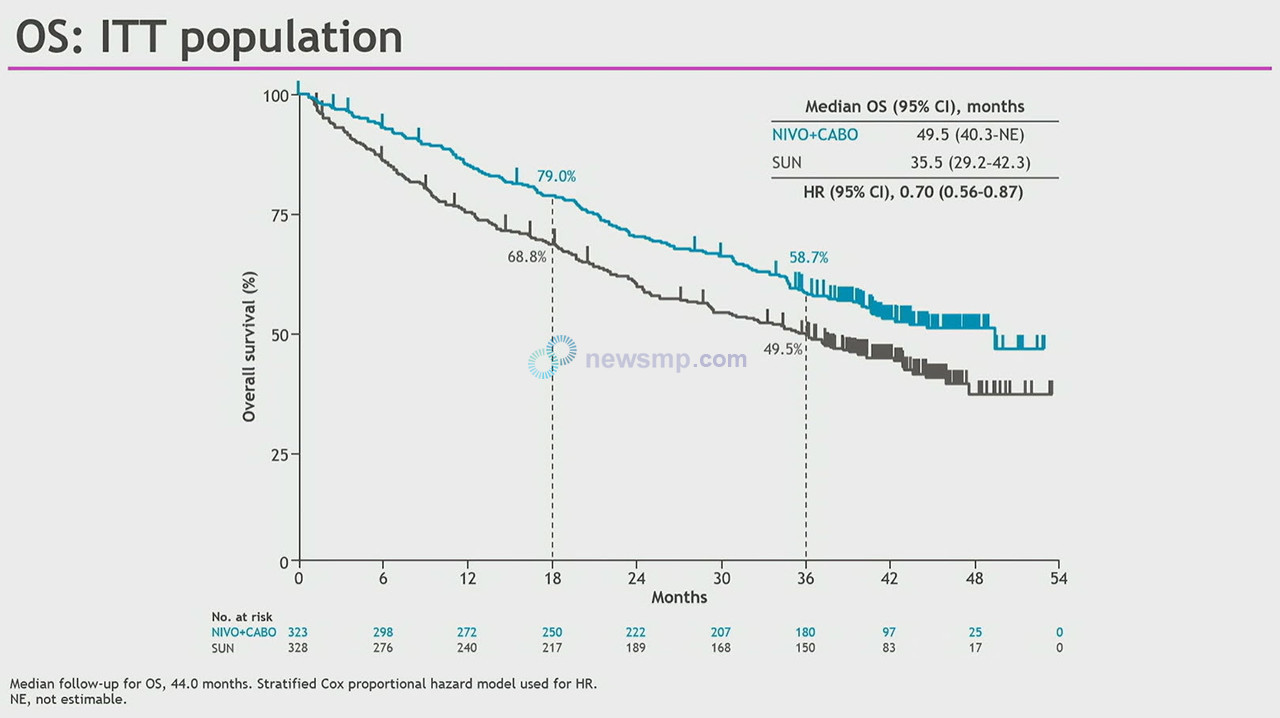
이어 지난해 공개된 2년차 분석(중앙 추적관찰 32.9개월)에서는 옵디보+카보메틱스 병용요법군과 수텐군의 무진행 생존기간 중앙값이 16.6개월과 8.3개월로 유지됐으나, 이득의 크기는 조금 줄어들었다.(HR=0.56, 95% CI 0.46−0.68, P<0.0001)
앞서 집계되지 않았던 옵디보+카보메틱스 투약군의 전체생존기간 중앙값은 37.7개월 수텐군은 34.3개월로 옵디보+카보메틱스 투약군의 사망의 위험이 30% 더 낮은 것으로 집계됐다.(HR=0.70, 95% CI 0.55–0.90, P=0.0043)
19일 공개된 3년차 분석에서는 옵디보+카보메틱스 투약군의 무진행생존기간 중앙값이 16.6개월로 유지된 반면, 수텐군은 8.4개월로 소폭 증가, 이득의 크기가 조금 더 줄어들었다.(HR=0.58, 95% CI, 0.48–0.71, P<0.0001).
객관적반응률은 56%와 28%로 이전 보고와 큰 차이가 없었으나, 완전반응률은 옵디보+카보메틱스군이 12%로 크게 늘었다.
반응지속기간 중앙값은 옵디보+카보메틱스군과 수텐군 모두 증가, 각각 23.1개월과 15.2개월로 집계됐다.
나아가 전체생존기간 중앙값은 옵디보+카보메틱스군이 49.5개월로 2년차 분석보다 11.8개월 더 증가했으며, 수텐군은 35.5개월로 1.2개월 증가했다.
2년차 분석과 비교하면 전체생존에 있어 수텐 대비 옵디보+카보메틱스 병용요법의 이득의 크기는 차이가 없었지만, 통계의 힘은 더욱 커졌다.(HR 0.70, 95% CI 0.56–0.87, P=0.0014).
아울러 3년차 분석에서는 환자의 위험도에 따라 반응률을 평가했는데, 위험도에 상관없이 옵디보+카보메틱스 병용요법군의 객관적반응률과 완전반응률이 더 높았다.
다만, 고위험군(poor risk)에 비해 저위험군(Favorable risk)에서는 옵디보+카보메틱스 병용여법군의 무진행생존이나 전체생존 이득이 뚜렷하지 않았다.
다른 연구에서는 옵디보+카보메틱스 치료의 이득을 볼 수 있는 환자를 선별하기 위해 바이오마커 분석을 진행했는데, PD-L1 발현율이나 C-met 등에 무관하게 옵디보+카보메틱스 치료의 이득이 더 컸다.
이외에 일부 좋은 예후를 기대할 수 있을 것으로 보이는 바이오마커들도 있었지만 반드시 좋은 예후로 이어지지는 않아서 바이오마커 확보가 과제로 남았다.
◇COSMIC-313, 중간 위험군에서 더 뚜렷한 효과
이전 치료 경험이 없는 진행성 신세포암 환자에서 옵디보와 여보이(성분명 이필리무맙, BMS), 카보메틱스 3제 요법을 옵디보와 여보이 2제 요법과 비교한 COSMIC-313 3상 연구의 추가 분석에서는 3제 요법의 이득이 중간위험군(intermediate risk)에서 더 뚜렷하게 나타난 것으로 확인됐다.
이 연구는 총 855명을 모집해 진행했는데, 550명까지의 환자군(PITT)과 전체 환자군(ITT)으로 구분해 평가했다.
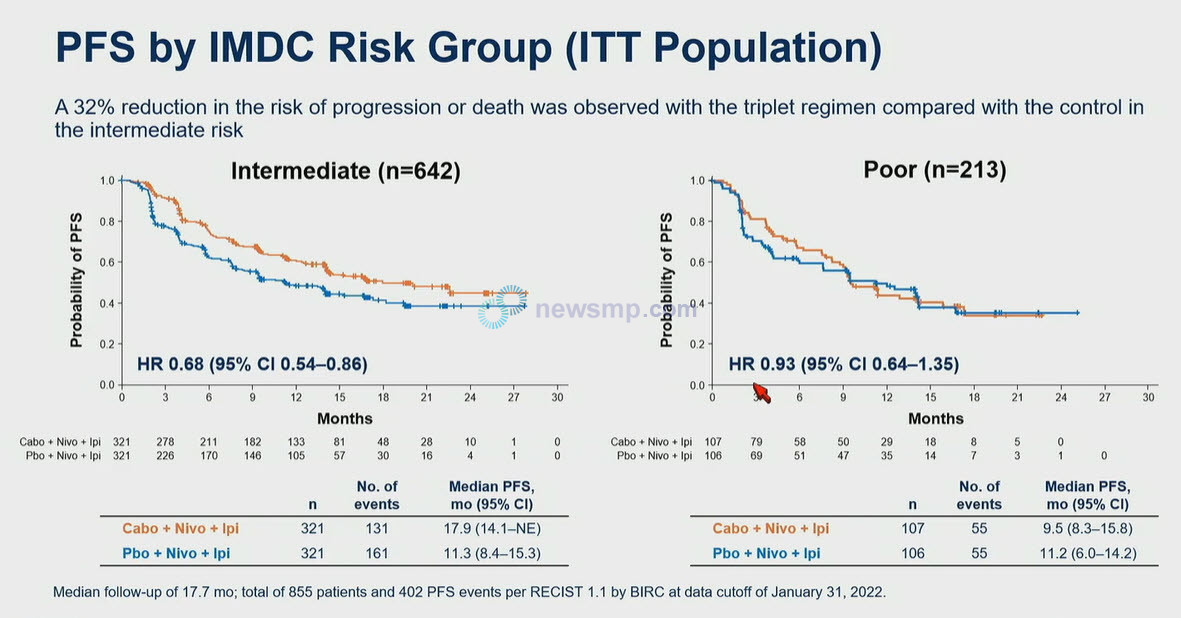
지난해 9월 유럽임상종양학회 연례학술회의(ESMO 2022)에서 발표된 첫 번째 분석에서는 1차 평가변수인 PITT군의 무진행생존기간이 3제 요법군에서는 중앙값에 이르지 않았던 반면, 2제 요법군은 11.3개월로 3제 요법군의 질병 진행 또는 사망의 위험이 27% 더 낮은 것으로 집계됐다.(HR=0.73, 95% CI 0.57-0.94, P=0.013),
19일 발표된 추가 분석에서는 PITT군과 ITT군 모두 3제 요법군의 질병 진행 또는 사망의 위험이 26% 더 낮은 것으로 보고됐다,(HR=0.74, PITT군 95% CI 0.58-0.95, ITT군 95% CI 0.61-0.90)
이 가운데 위험도에 따른 분석에서 저위험군은 3제 요법군의 질병 진행 또는 사망의 위험이 32% 더 낮았으나(HR=0.68, 95% CI 0.54-0.86), 고위험군에서는 큰 차이를 보이지 않았다(HR=0.93, 95% CI 0.64-1.35).
객관적반응률 역시 중간위험군에서는 3제 요법이 45%로 2제 요법의 35%를 상회했으나, 고위험군에서는 37%와 38%로 차이가 없었다.
다만 질병조절률(Disease Control Rate, DCR)은 중간위험군(3제 요법 88%, 2제 요법 75%)과 고위험군(3제 요법 81%, 2제 요법 64%) 모두 3제 요법이 더 높았다.
이와 관련, 연구진은 3제 요법이 고위험군에서도 수치적으로는 치료 성적을 개선했지만, 주로 중간 위험군에서 이득을 보였다고 평가했다.
◇옵디보 기반 요법, 저위험 전이성 투명세포 신세포암에서 뚜렷한 이득
상대적으로 이전 치료 경험이 없는 진행성 투명세포 신세포암 환자를 대상으로 진행하고 있는 HCRN GU16-260 임상 2상의 Cohort A 분석에서는 옵디보 기반 요법의 이득이 저위험군에서 더 뚜렷하게 나타났다.
이 연구는 총 128명(저위험군 38명, 중간 위험군 78명, 고위험군 12명)을 대상으로 옵디보 단독요법을 평가하고 있다.
다만, 옵디보 단독요법 중 질병이 진행하면 옵디보와 여보이 병용요법으로 치료를 이어갈 수 있도록 했다.
치료 기간은 단독요법을 유지한 경우 최대 86주, 여보이 병용요법으로 전환한 경우 108주로 설정했다.
이어 치료 중단 후 후속 치료 또는 사망에 이르기까지의 시간으로 정의한 무치료 생존기간(Treatment-Free Survival, TFS)를 평가했으며, 이 가운데 3등급 이상 반응 없이 생존한 기간을 추가로 분석했다.
분석 결과 객관적반응률은 전체 환자에서 35.9%이었으며, 이 가운데 저위험군이 57.9%로 중간위험군의 25.6%나 고위험군의 33.3%를 크게 상회했다.
3년 시점의 무진행생존율은 전체 환자에서 14.6%였으며, 역시 저위험군이 31.2%로 중간 및 고위험군의 7.2%를 크게 웃돌았다.
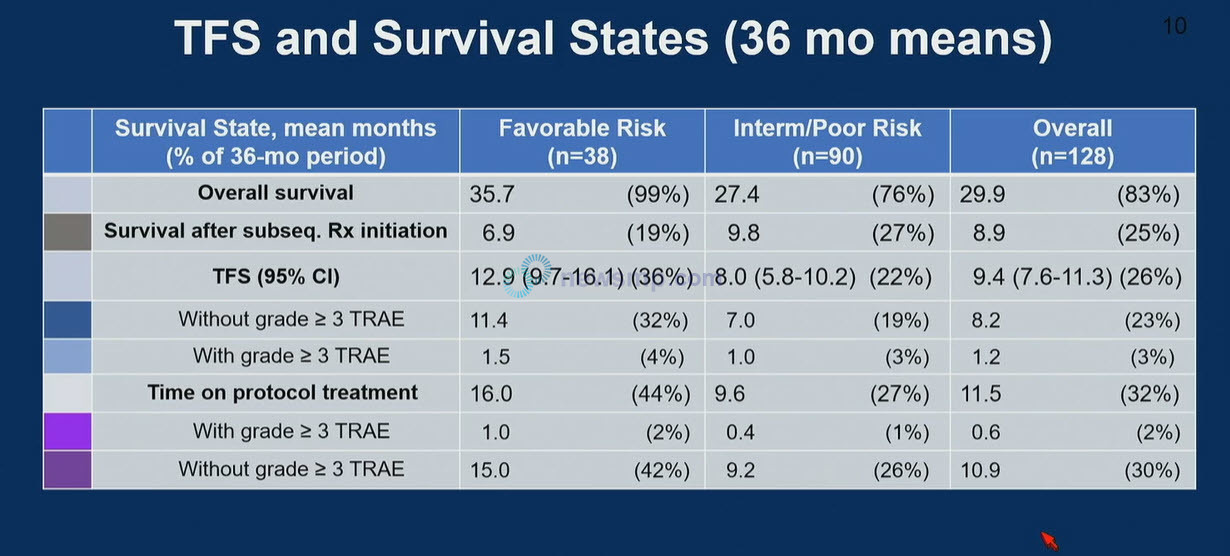
전체생존기간 중앙값 및 3년 전체생존율은 저위험군이 35.7개월에 99%로 중간 및 고위험군이 27.4개월에 76%를 상회했으며, 전체 환자에서는 29.9개월에 83%로 보고됐다.
무치료 생존기간 중앙값 및 3년 무치료 생존율 또한 저위험군이 12.9개월과 36%로 중간 및 고위험군의 8.0개월, 22%를 웃돌았으며, 전체 환자에서는 9.4개월에 26%로 집계됐다.
치료 관련 3등급 이상의 이상반응 없이 생존한 기간 중앙값 및 3년 시점까지 치료 관련 3등급 이상의 이상반응이 없었던 환자도 저위험군이 11.4개월에 32%, 중간 및 고위험군의 7.0개월에 19%를 크게 상회했으며, 전체 환자에서는 8.2개월에 23%로 집계돼 무치료 생존기간 대부분을 3등급 이상의 치료관련 이상반응 없이 생존한 것으로 확인됐다.
정해진 치료를 유지한 기간 및 3년 시점의 유지율은 저위험군이 16.0개월에 44%로 중간 및 고위험군의 9.6개월, 27% 보다 두 배 가까이 높았으며, 전체 환자는 11.5개월에 32%로 보고됐다.
치료와 관련한 3등급 이상의 이상반응 없이 치료를 유지한 기간 및 3년 시점까지 치료와 관련한 3등급 이상의 이상반응 없이 치료를 유지한 환자는 저위험군이 15.0개월에 42%, 중간 및 고위험군은 9.2개월에 26%, 전체 환자에서는 10.9개월에 30%로 역시 치료를 유지한 기간 대부분 치료와 관련한 3등급 이상의 이상반응이 나타나지 않았다.
◇카보메틱스, 면역항암요법 경험한 진행성 신세포암 환자에서 유망한 결과 도출
진행성 신세포암에서 옵디보와 시너지를 발휘하고 있는 카보메틱스는 병용에 이어 후속치료에서도 가치를 입증했다.
CaboPoint 임상 2상을 통해 이전에 카보메틱스가 포함되지 않은 면역항암요법을 받았던 진행성 신세포암 환자에서 유망한 결과를 도출한 것.
이 연구는 이전에 진행성 신세포암 1차 치료로 옵디보와 여보이 병용요법을 받았던 환자 60명과 키트루다(성분명 펨브롤리주맙, MSD)와 인라이타(성분명 엑시티닙, 화이자) 병용요법 또는 바벤시오(성분명 아벨루맙, 화이자ㆍ머크)와 인라이타 병용요법을 받았던 28명을 대상으로 카보메틱스 단독요법을 평가하고 있다.
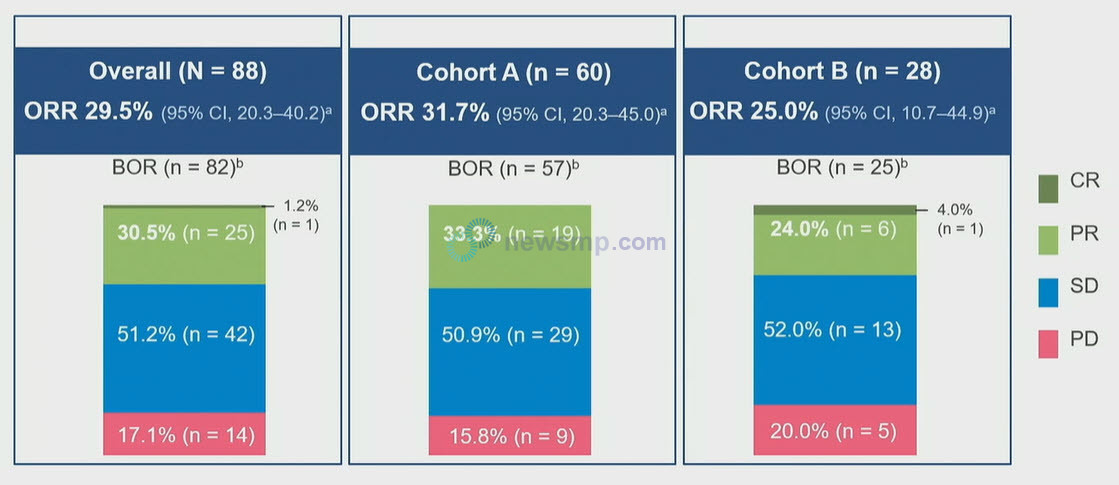
19일 공개된 중간 분석에서는 반응률만 집계됐는데, 이전에 옵디보와 여보이 병용요법을 받았던 환자에서는 객관적반응률이 31.7%, 최고의 객관적반응률(Best Overall Response, BOR)은 95.0%로 집계됐다.
또한 이전에 키트루다와 인라이타 또는 바벤시오와 인라티아를 투약했던 환자에서는 객관적반응률이 25.0%, 최고의 객관적반응률은 89.3%로 집계돼, 전체적으로는 객관적반응률이 29.5%, 최고의 객관적반응율은 93.2%로 보고됐다.
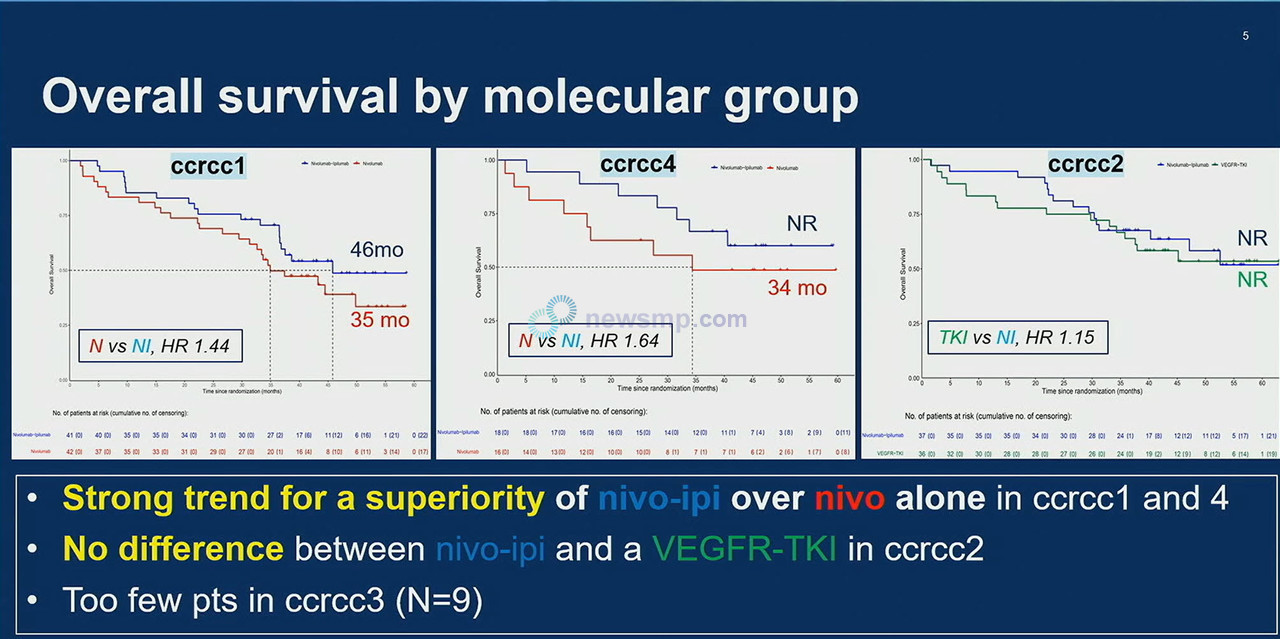
◇프랑스 연구진, 환자에 따른 최적의 치료법 선택 가능성 제시
프랑스 연구진은 전이성 신세포암에서 옵디보 단독요법과 옵디보+여보이 병용요법, 혈관내피성장인자 억제제(VEGFR-TKI) 등 3가지 옵션을 환자의 특성에 따라 평가한 무작위 배정 임상 2상, BIONIKK연구 결과를 발표하며 맞춤 치료의 가능성을 제시했다.
연구진은 총 199명의 진행성 신세포암 환자들을 각각 △수텐에 잘 반응하지 않는 저염증, 저침윤성 종양 미세환경의 환자(1그룹), △혈관생성에 특이적이고 고염증 면역 미세환경으로 수텐에 잘 반응하는 환자(2그룹) △정상적인 신장 조직에 가까운 분자 및 병리학적 특성으로 수텐에 잘 반응하는 환자(3그룹) △면역관문억제제 마커 발현이 높고 고염증, 고침윤성 종양 미세환경의 환자(4그룹)으로 구분했다.
앞서 발표됐던 1차 분석(중앙 추적관찰 18개월)에서는 1그룹에서 옵디보 단독요법과 옵디보+여보이 병용요법의 객관적반응률이 29%와 39%, 무진행생존기간 중앙값은 5.2개월과 7.7개월로 집계됐다.
2그룹은 옵디보+여보이 병용요법과 VEGFR-TKI 병용요법의 객관적반응률이 50%와 51%, 무진행생존기간 중앙값은 11.1개월로가 14.4개월로 보고됐다.
3그룹은 옵디보+여보이 병용요법과 VEGFR-TKI 병용요법의 객관적반응률이 20%와 0%, 무진행생존기간 중앙값은 16.0개월과 3.2개월로 집계됐다.
4그룹은 옵디보 단독요법과 옵디보+여보이 병용요법의 객관적반응률이 44%와 50%, 무진행생존기간 중앙값은 7.8개월과 13.0개월로 보고됐다.
전반적으로 옵디보와 여보이 병용요법이 옵디보 단독요법보다 더 나은 성적을 보였고, 4그룹보다 1그룹에서 옵디보 기반요법의 성적이 더 좋았으나, 2그룹에서는 VEGFR-TKI의 치료 결과가 더 좋았다는 평가다.
이어 19일에는 중앙추적관찰 46.5개월 시점의 분석 결과가 공개됐다. 전반적으로는 수치상에 일부 변화가 있었으나 1차 분석의 흐름이 유지됐다.
1그룹에서 객관적반응률과 무진행생존기간 중앙값, 후속치료까지의 시간(Time to Subsequent Therapy, TST) 중앙값이 옵디보 단독요법은 31%, 5개월, 11개월, 옵디보+여보이 병용요법은 44%, 8개월, 13개월로 집계됐다.
2그룹에서는 옵디보+여보이 병용요법이 54%, 11개월, 22개월, VEGFR-TKI가 58%, 14개월 16개월로 보고됐다.
3그룹에서는 옵디보+여보이 병용요법이 20%, 16개월 17개월, VEGFR-TKI는 0%, 2.4개월, 4개월로 집계됐다.
4그룹은 옵디보 단독요법이 44%, 8개월 13개월, 옵디보+여보이 병용요법은 55%, 13개월 29개월로 나타났다.
1차 분석에서 집계되지 않았던 전체생존기간 중앙값은 1그룹에서 옵디보 단독요법군이 35개월, 옵디보+여보이 병용요법군이 46개월로 옵디보 단독요법의 사망위험이 더 높았다.(HR=1.44)
4그룹에서도 옵디보 단독요법의 전체생존기간 중앙값이 34개월에 머문 반면 옵디보+여보이 병용요법군은 중앙값에 이르지 않아 옵디보 단독요법의 사망 위험이 더 높은 것으로 집계됐다.(HR=1.64)
2그룹에서는 옵디보+여보이 병용요법과 VEGFR-TKI 그룹 모두 중앙값에 이르지 않은 가운데 사망의 위험에서도 큰 차이를 보이지 않았으며(HR=1.15), 3그룹은 표본이 작아 집계되지 않았다.
옵디보 단독요법은 1그룹에 배정된 환자 중 32%, 4그룹에서 11% 등 총 27%의 환자가 후속치료를 받았다.
옵디보+여보이 병용요법군은 1그룹에서 31%, 2그룹에서 62%, 3그룹에서 67%, 4그룹에서 33% 등 총 45%가 후속 치료를 받았으며, VEF-TKI 군은 2그룹에서만 57%가 후속치료를 받았다.
연구에 참여한 총 199명의 환자 중 133명(67%)이 후속치료를 받았으며, 이 가운데 106명(79%)이 VEGFR-TKI를 선택했으며, 후속치료로 선택한 VEGFR-TKI 중에서는 카보메틱스가 54%로 가장 많았고 수텐과 보트리엔트(성분명 파조파닙, 노바티스)가 30%, 인라이타가 14%로 집계됐다.
후속 VEGFR-TKI 치료의 무진행생존율(PFS2)은 옵디보 단독요법이 1그룹에서 8.3개월, 4그룹에서 9.9개월 등 전체 환장서 8.7개월로 집계됐다.
옵디보+여보이 병용요법은 1그룹에서 9.2개월, 2그룹에서 12.0개월, 4그룹에서 12.0개월이었고, 3그룹은 중앙값에 이르지 않았으며, 전체적으로는 11.4개월로 집계됐다.
2그룹에서 1차 치료로 VEGFR-TKI를 받았던 환자들의 2차 무진행생존기간 중앙값은 12.0개월로 보고됐다.
결과적으로 옵디보+여보이 병요용법은 2, 4그룹에서 더 높은 효능을 보였으며, VEGFR-TKI는 2그룹에서 잘 반응했고, 전반적으로는 옵디보 단독요법보다 여보이 병용요법의 효능이 더 컸다는 평가다.
한편, 다른 연구에서는 뇌전이를 동반한 신세포암 환자의 1차 치료에서 면역항암요법(면역+면역 또는 면역+VEGFR-TKI)을 VEGFR-TKI 단독요법과 비교했는데, 반응률에서는 큰 차이가 없었으나 생존율에서는 면역항암화학요법이더 유리했다고 보고했다.


