[의약뉴스] 셀트리온이 개발중인 스텔라라(성분명 우스테키누맙, 얀센) 바이오시밀러 CT-P43이 스텔라라와의 직접 비교임상에서 긍정적인 결과를 도출했다.
9일(현지시간) 유럽피부과학회 연례학술회의(EADV 2022)에서 발표된 3상 임상의 중간 분석에서 스텔라라와 유사한 안전성과 유효성을 보여준 것.
이 임상은 판상건선 병력이 24주 이상인 18세 이상 80세 이하 성인으로, 건선중증도지수(PASI) 12 이상, 체표면적(BSA) 10% 이상, 글로벌 건선 평가 척도(sPGA) 3 이상인 환자 509명을 대상으로 진행됐다.
환자들은 각각 스텔라라와 CT-P43 투약군에 1대 1로 배정돼 체중에 따라 45mg 또는 90mg을 투약했으며, 첫 2회(0주, 4주) 투약 후 12주에 1차 평가변수를 분석했다.
또한 16주차에는 CT-P43 투약군은 약제를 변경하지 않고, 스텔라라 투약군은 다시 1대 1로 나눠 CT-P43 전환군과 스텔라라 유지군에 배정, 3차례(16주, 28주, 30주) 추가 투약한 후 52주까지 관찰했다.
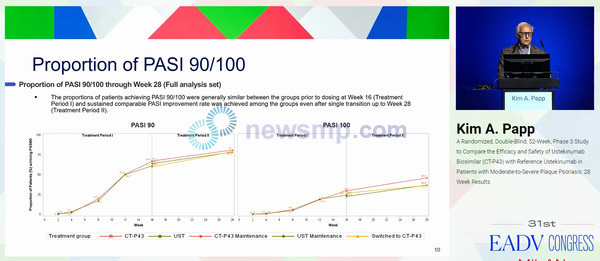
이번에 발표된 중간 분석은 28주 시점의 분석 결과로, 첫 번째 중간 분석인 12주와 28주 모두 양 군간에 안전성과 유효성에서 차이가 없는 것으로 확인됐다.
먼저 12주에는 기저치 대비 PASI 개선율이 CT-P43은 평균 86.5%(±14.833%), 스텔라라는 83.99%(±17.484), 중앙값은 각각 90.21%와 90.69%로 차이가 없었다.
이 가운데 PASI 50 달성률은 CT-P43이 96.5%, 스텔라라가 94.9%, PASI 75는 82.8%와 73.9%, PAS 90은 50.4%와 50.2%, PASI 100은 18.4%와 19.0%로 집계됐다.
글로벌 건선 평가 척도가 0(완벽하게 개선) 또는 1(거의 개선)로 개선된 환자의 비율도 CT-P43이 85.5%, 스텔라라는 79.4%로 유사했다.
피부관련 삶의 질(DLQI) 변화도 CT-P43이 –9.7±6.74, 스텔라라가 –8.5±6.67로, 중앙값은 –9.0과 –7.0으로 유사하게 나타났다.
이어 스텔라라 투약군을 유지군과 CT-P43 전환군으로 나누어 치료를 이어간 후 28주에 분석한 결과 역시 CT-P43 유지군과 스텔라라 유지군, CT-p43 전환군 모두 유사한 양상을 보였다.
기저치대비 PASI 개선율은 CT-P43 유지군이 95.7%(±8.303), 스테랄라 유지군이 92.55%(±13.704), CT-P43 전환군이 92.86(±10.609)로 집계됐다.
이 가운데 PASI 50 달성률은 각각 98.8%, 96.8%, 99.2%, PASI 75는 96.4%, 92.8%, 93.5%, PASI 90은 81.0%, 78.4%, 79.0%, PASI 100은 45.8%, 36.8%, 36.3%로 보고됐다.
글로벌 건선 평가 척도가 0 또는 1로 개선된 환자 또한 91.7%와 88.8%, 91.1%로 큰 차이가 없었고, 피부관련 삶의 질 역시 –10.9±7.20, -8.8±6.95, -9.4±6.66, 중앙값은 –10.0, -8.0, -8.5로 유사했다.
안전성 역시 양 군간에 큰 차이가 없었다는 것이 연구진의 설명이다.


