대웅제약이 폐섬유증 치료제 ‘DWN12088’ 개발을 위한 국내 임상 1상 시험에 들어갈 전망이다.
DWN12088은 PRS(Prolyl-tRNA Synthetase) 저해제 후보물질로, 대웅제약이 보유하고 있는 First-in-class(세계 최초 혁신 신약) 파이프라인 중 하나다.
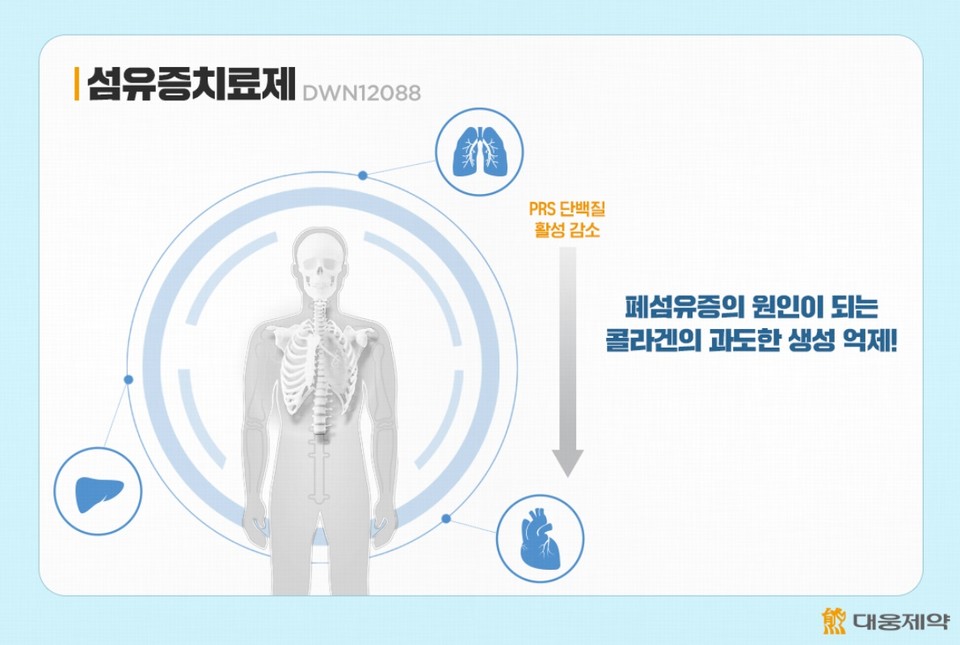
‘섬유증’은 콜라겐 성분이 뭉쳐 조직이 딱딱하게 굳는 질병이다. 이 중 ‘특발성폐섬유증’은 폐가 서서히 굳어지면서 폐 기능을 상실해가는 간질성 질환으로, 치료가 어렵고 진단 후 5년 생존율이 40% 미만으로 알려져 있다.
DWN12088은 PRS 단백질의 활성만을 선택적으로 감소시켜 폐섬유증의 원인이 되는 콜라겐의 과도한 생성을 억제하는 기전을 가졌다.
대웅제약은 전임상을 통해 폐섬유증 동물모델에서 기존 약물 대비 DWN12088의 우수한 효능과 안전성을 확인한 바 있다.
2019년 9월에는 호주 식품의약청(TGA)으로부터 현지 임상1상 시험을 승인받아 글로벌 임상 1상에 착수하기도 했다.
이 같은 상황에서 대웅제약은 국내에서 건강한 사람을 대상으로 DWN12088의 안전성, 내약성 확보 등을 위한 임상시험을 추진한다.
식품의약품안전처는 대웅제약의 ‘DWN12088정’에 대한 국내 임상 1상 시험계획을 8일 승인했다.
이에 따라 대웅제약은 건강한 성인에게 DWN12088정을 경구투약 후 약동학적 특성과 안전성에 대한 식이 영향을 평가하는 임상시험을 진행할 예정이다.
임상시험은 무작위배정, 공개, 단회 투약, 교차설계 방식을 사용해 서울대학교병원에서 실시할 계획이다.
한편, DWN12088은 섬유증 치료제 약물 개발 필요성을 인정받아 범부처신약개발사업단 지원과제 대상으로 선정되기도 했다. 2019년에는 미국 식품의약국(FDA)으로부터 희귀의약품으로 지정된 바 있다.


