식품의약품안전처로부터 허가를 받아 시판 중인 의약품일지라도, 사용 안전성을 지속적으로 확보하기 위한 장치는 필요하다.
이에 정부는 의약품 시판 후 안전관리 제도를 운영하고 있는데 ▲재심사 ▲위해성관리계획(RMP, Risk Management Plan)이 대표적이다.
의약품 시판 후 안전관리를 위한 제도 중 하나인 ‘재심사’는 신약 또는 일부 전문의약품에 대해 허가 후 일정기간(4~6년) 동안 불특정 다수를 대상으로 부작용 등을 조사해 안전성ㆍ유효성을 재심사하는 것을 말한다. 1995년 도입돼 지금까지 운영되고 있다.
2015년 도입된 ‘위해성관리계획(RMP)’을 통해서는 신약, 희귀의약품 등에 대해 약물감시계획, 위해성 완화조치방법 등을 포함하는 종합적인 안전관리 계획을 수립ㆍ이행토록 제약사에게 의무를 부과한다.
위해성관리계획은 허가신청 때 제출한다. 만약, 제출한 계획을 제대로 이행하지 않으면 상대적으로 가벼운 행정처분부터 해당 품목의 판매정지 처분까지 이뤄질 수 있다.
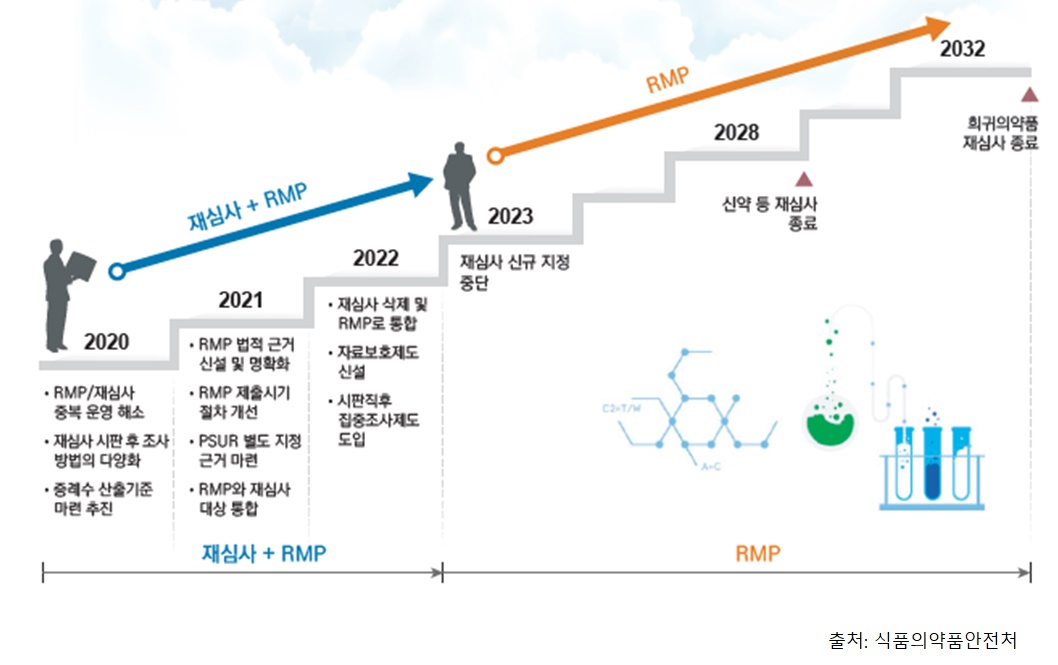
한편, 식약처는 지금까지 운영해온 의약품 시판 후 안전관리 제도(재심사 및 위해성관리계획)를 개선하겠다고 최근 밝혔다.
시판 후 안전관리 대상 의약품이 매년 증가하고, 위해성관리계획 품목의 77.5%가 재심사 대상으로도 지정되고 있기 때문에 ‘자료 중복제출’ 등에 대한 개선이 필요하다는 것이다. 2019년 기준 위해성관리계획 의약품은 전년 대비 275품목(195%), 재심사 의약품은 196품목(134%) 증가했다.
개선방안의 핵심은 ‘재심사’ 제도를 전(全) 주기 안전관리 체계인 ’위해성관리계획(RMP)‘으로 통합 운영하는 것이다.
의약품 시판 후 안전관리 제도를 ‘일원화’하겠다는 건데, 3년간(2020~2022년) 3단계에 걸쳐 추진할 계획이다.
이와 관련해서는 올해(2020년) ‘위해성관리계획ㆍ재심사 중복 해소’를, 내년(2021년)에는 ‘위해성관리계획 효율성 강화’를, 2022년까지 ‘위해성관리계획으로 의약품 시판 후 안전관리 제도 일원화’를 완성한다는 로드맵을 세웠다.
제도개선 과정에서는 추가적인 약물감시 제도도 도입될 것으로 보인다. 가칭 ‘시판 직후 집중모니터링’으로 명명된 이 제도는 신약, 자료제출의약품 등 안전 정보가 제한적인 의약품에 대해 시판 직후 일정 기간 의약품 사용 정보를 적극적으로 수집하기 위한 목적으로 2022년께 도입될 예정이다.
정부의 계획대로라면, 2023년을 기점으로 재심사 신규 지정이 중단되고, 2028년 말에는 신약 등 재심사 종료, 2032년 말에는 희귀의약품 재심사 종료가 이뤄질 전망된다.


