다수의 글로벌 제약사가 알츠하이머 치료제 개발을 추진하는 가운데 국내에서도 활발한 연구가 진행되고 있다.
한국보건산업진흥원이 23일 발간한 보고서에 따르면 현재 국내 기업이 개발 중인 알츠하이머 치료제 임상시험은 총 6건으로 모두 임상1~2상에 머물러 있다.
가장 최근 임상시험을 승인 받은 사례부터 살펴보면 젬백스앤카엘이 펩타이드의약품인 GV1001의 임상2상시험을 지난해 12월 승인 받았으며, 네이처셀은 FDA로부터 줄기세포치료제 아스트로스템의 임상1/2상을 지난해 11월 승인 받았다.
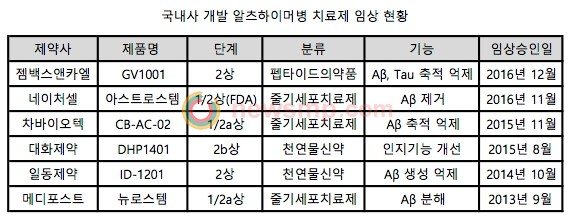
2015년에는 차바이오텍과 대화제약이 각각 CB-AC-02(줄기세포치료제), DHP1401(천연물신약)의 임상1/2a상과 2b상을 승인 받았고, 일동제약은 2014년 천연물신약 ID-1201의 임상2상 시험을, 메디포스트는 2013년 줄기세포치료제 뉴로스템의 1/2a상을 승인 받은 바 있다.
분류별로는 줄기세포치료제가 3건, 천연물신약 1건, 펩타이드의약품 1건으로, 글로벌 파이프라인의 경우 합성의약품이 71%에 달하는 것과 비교했을 때 차이를 보이고 있다.
이와 함께 국내에서는 오리지널 제제의 약효 지속 기간을 증가시키거나 고령환자의 순응도와 안전성을 증진시키는 제형 등 기존 제품과의 차별화를 노린 제네릭 개발도 진행되고 있다.
일례로 동국제약은 도네페질을 1회 투여로 1개월간 약효가 지속되도록 하는 주사제 DKF-310의 임상1상 시험을 지난 2015년 승인 받은 바 있으며, 아이큐어는 경피약물전달 원천기술을 활용한 도네페질 패취제 개발 임상3상을 지난해 2월 승인 받았다.
SK케미칼은 2013년 EU에서 허가를 받은 엑셀론 패취의 복제약을 지난해 4월 FDA에 허가 신청하기도 했다.
한편 보고서에서는 최근 글로벌 파이프라인의 임상3상 실패에 따라 비교적 초기 단계의 환자를 진단 및 치료하는 것의 중요성이 부각되고 있다고 설명하기도 했다.
후보물질들의 임상3상 시험이 연거푸 실패한 이유가 약물치료 시점이 너무 늦은 것일 수 있다는 판단에 따른 것으로, FDA도 초기 단계 알츠하이머 치료제 개발의 중요성을 인지해 관련 임상시험 가이드라인을 발표했기 때문이다.
아울러 보고서는 “규제당국의 신약 신속심사 제도 등을 적극 활용해 글로벌 시장을 빠르게 선점하기 위한 전략이 필요하며, 이를 개발 단계에서부터 고려할 필요가 있다”면서 “치료제 개발 성공 확률이 낮은 만큼 국내외 견고한 협력관계 구축과 정부·민간의 적극적인 투자가 더욱 중요해질 것으로 보인다”고 밝혔다.


